|
Experimento a largo plazo de la evolución de E. Coli El experimento a largo plazo de la evolución de E. coli (LTEE por sus siglas en inglés, long-term evolution experiment) es un estudio en marcha de la evolución experimental dirigido por Richard Lenski que ha ido siguiendo los cambios genéticos de 12 poblaciones inicialmente idénticas de la bacteria asexual Escherichia coli desde el 24 de febrero de 1988.[2] Las poblaciones alcanzaron 50 000 generaciones en febrero de 2010 y de 65 000 en junio de 2016[3] y 75 000 generaciones en 2022 [4] A lo largo del experimento, Lenski y sus compañeros han reportado una gran variedad de cambios fenotípicos y genotípicos en las poblaciones en evolución. Estos incluyen cambios que han ocurrido en las 12 poblaciones y otros que solo han aparecido en una o pocas poblaciones. Por ejemplo, las 12 poblaciones muestran un patrón similar de rápido mejoramiento de aptitud que desaceleró a lo largo del tiempo, mayor velocidad de crecimiento y un tamaño celular más grande. La mitad de las poblaciones han evolucionado defectos en la reparación del ADN que han ocasionado fenotipos mutadores evidentes por la elevada tasa de mutación. La adaptación más sorprendente reportada hasta ahora es la evolución de crecimiento aeróbico con citrato, el cual es raro en E. coli, en una población en algún momento entre las generaciones 31 000 y 31 500.[5][6] Enfoque experimentalEl experimento a largo plazo de evolución fue diseñado como una forma abierta de estudiar empíricamente las características centrales de la evolución. El experimento comenzó con tres objetivos principales:
Como el experimento ha continuado, su alcance ha crecido a medida que nuevas preguntas de la biología evolutiva que pueden ser contestadas han surgido, que la evolución de las poblaciones ha presentado nuevos fenómenos a estudiar y que la tecnología y técnicas metodológicas han avanzado.[8] El uso de E. coli como el organismo experimental ha permitido que se estudien muchas generaciones y poblaciones grandes en un periodo de tiempo relativamente corto. Además, debido al gran uso de E. coli como un organismo modelo principal en biología molecular, una gran variedad de herramientas, protocolos y procedimientos eran accesibles para estudiar los cambios a nivel genotípico, fenotípico y fisiológico.[9] La bacteria también puede ser congelada y preservada y permanecer siendo viable. Esto ha permitido la creación de lo que Lenski describe como un "registro fósil congelado" de muestras de poblaciones en evolución que pueden ser revividas en cualquier momento. Este registro fósil congelado permite que las poblaciones sean reiniciadas en caso de contaminación o otro problema durante el experimento y permite el aislamiento y comparación de ejemplares vivos de clones ancestrales y evolucionados. Lenski escogió una línea de E. coli que se reproduce solamente asexualmente, carece de plásmidos que puedan permitir la conjugación bacteriana y no tiene profago viable. Como consecuencia, la evolución del experimento ocurre únicamente por los procesos centrales de la evolución como mutaciones, derivas genéticas y selección natural. Esta asexualidad estricta también significa que los marcadores genéticos se mantienen en los linajes y clados de un antepasado común, pero no pueden extenderse de otra forma en las poblaciones.[7] Lenski decidió realizar el experimento con la bacteria en un medio de cultivo con glucosa limitada llamado DM25,[10] el cual fue inicialmente desarrollado por Bernard Davis para aislar las mutantes auxótrofas de E. coli utilizando penicilina como un agente selectivo.[11][12] DM25 es suplementado con una baja concentración de glucosa.[10] Lenski escogió esta concentración para simplificar el análisis de la evolución de las poblaciones al reducir la interferencia de clones, en la cual múltiples versiones de alelos están compitiendo en una población en evolución, mientras que también reducía la posibilidad de la evolución de interacciones ecológicas.[7] Esta concentración de glucosa puede mantener una población máxima de 500 millones de células del ancestro en un cultivo de 10 ml, aunque el máximo ahora varía dependiendo de la población.[11] DM25 contiene una gran cantidad de citrato (cerca de 11 veces la concentración de glucosa), que fue originalmente incluida por Davis porque mejoraba la eficiencia para matar de la penicilina durante sus experimentos, aunque ahora se sabe que ayuda a E. coli a la adquisición de hierro del medio.[11][13] MétodosLas doce poblaciones son mantenidas en una incubadora a 37 °C en el laboratorio de Lenski en la Universidad Estatal de Míchigan. Cada día se transfiere el 1% de la población a una matraz con nuevo medio de crecimiento DM25. La dilución significa que cada población experimenta 6,64 generaciones, o duplicaciones, cada día. Muestras representativas grandes de cada población son congeladas en glicerol como criopreservador en intervalos de quinientas generaciones (75 días). Las bacterias en estas muestras permanecen viables y pueden ser revividas en cualquier momento. Esta colección de muestras se le conoce como "registro fósil congelado" y proporciona una historia de la evolución de cada población a través de todo el experimento. Las poblaciones también son regularmente analizadas para detectar cambios en la aptitud promedio y otros estudios son realizados para estudiar desarrollos interesantes en las poblaciones.[14] Desde abril de 2016, las poblaciones de E. coli han sido estudiadas por más de 64 500 generaciones, y se cree que han sufrido suficientes mutaciones espontáneas que cada mutación puntual posible ha ocurrido múltiples veces en el genoma de E. coli.[5] Cepa inicialLa cepa de E. coli que utilizó Lenski para comenzar en experimento a largo plazo de evolución proviene de la "strain [cepa] Bc251", descrita en un artículo de 1966 por Seymour Lederberg, vía Bruce Levin, quien la había utilizado en un experimento de ecología bacteriana en 1972. Las características genéticas de la cepa son: T6r, Strr, r-m-, Ara- (incapaz de crecer en arabinosa).[2] Lenski nombró la cepa original como REL606. Antes de comenzar el experimento, Lenski aisló una variante Ara+ de la cepa en donde una mutación puntual en el operón ara había restablecido el crecimiento en arabinosa, cepa a la cual llamó REL607. Las poblaciones fueron comenzadas a partir de 6 colonias Ara- de REL606 y 6 Ara+ de REL607. Estas diferencias permiten que se diferencien grupos de cepas en Tetrazolium Arabinose plates, sobre las cuales las colonias Ara- aparecen rojas mientras que las colonias Ara+ son de blancas a rosas. A lo largo del experimento, cada población ha acumulado una gran cantidad de mutaciones diferentes que permiten identificar por más medios las cepas a través de su población de origen. ResultadosCambios en la aptitud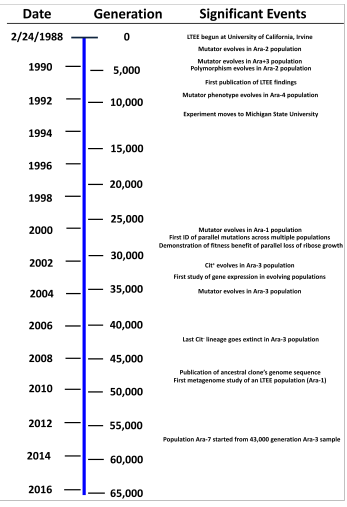 Muchos análisis de experimento han visto como la aptitud relativa de las poblaciones ha cambiado a comparación de la cepa original. Todas las poblaciones muestran un patrón de mejora de aptitud relativa rápida durante las primeras generaciones con un incremento desacelerado a lo largo del tiempo. Para las 20 000 generaciones, las poblaciones crecían aproximadamente un 70% más deprisa que la cepa ancestral.[7] Este aumento y desaceleración ha continuado en generaciones subsecuentes. Un estudio de 2013 por Wiser et al. reportó que el mejoramiento continuaba después de 50 000 generaciones en comparación de las muestras aisladas a las 40 000 generaciones. Encontraron que la aptitud incrementaba seguía un modelo de ley potencial mucho mejor que los modelos hiperbólicos que habían sido utilizados previamente. Como un modelo de ley potencial describe un incremento desacelerado sin límite superior mientras que el modelo hiperbólico implica un límite, el trabajo sugirió que el incremento continuaría sin límite mientras que mutaciones benéficas cada vez más escasas se fijaran en las poblaciones.[17] Trabajos posteriores en el 2015 reportaron los resultados de más de 1100 nuevos estudios de aptitud que analizaban los cambios de aptitud a lo largo de 60 000 generaciones. La información otra vez seguía un modelo de ley potencial, y, efectivamente caía dentro de las predicciones del modelo obtenido con información anterior. Estos resultados sugieren que, contrario al pensamiento previo, la adaptación y divergencia adaptativa pueden aumentar potencialmente indefinidamente, aun en un ambiente constante.[18][19] Evolución del genomaDe las 12 poblaciones, seis han sido reportadas por tener defectos en su habilidad para reparar en ADN, aumentando considerablemente la velocidad de mutación en esas cepas.[6][20][21] Aunque las bacterias de cada población se creen que han generado cientos de millones de mutaciones durante las primeras 20 000 generaciones, Lenski estimó que dentro de este periodo de tiempo, solamente de 10 a 20 mutaciones benéficas lograron fijarse en cada población, con menos de 100 mutaciones puntuales totales (incluyendo mutaciones neutrales) alcanzando fijarse en cada población.[7] En 2009, Barrick et al. reportó los resultados de secuenciaciones del genoma de varios puntos en el tiempo de la población Ara-1. Encontraron que, a diferencia de la desaceleración del mejoramiento de aptitud, la acumulación de las mutaciones era lineal y periódica, aunque varias evidencias sugerían que muchas de las acumulaciones eran benéficas, en vez de neutras.[22] Evolución del incremento de tamaño celular en las doce poblacionesTodas las poblaciones experimentales muestran un incremento en el tamaño celular simultáneo con una disminución de la máxima densidad de población y, en muchas poblaciones, una forma más redonda de la célula.[23] Este cambio se debe en parte al resultado de una mutación que cambió la expresión de un gen para una proteína de unión a penicilina, la cual permitió a la bacteria mutante a superar a la bacteria ancestral bajo las condiciones del experimento a largo plazo de evolución. Sin embargo, aunque la mutación aumentó la aptitud en estas condiciones, también aumentó la sensibilidad de la bacteria al estrés osmótico y disminuyó su habilidad para sobrevivir largos periodos en fases estacionarias.[23] Especialización ecológicaA lo largo del experimento, las poblaciones han evolucionado para especializarse en la glucosa en la que crecen. Esto fue descrito por primera vez en el 2000, cuando Cooper y Lenski demostraron que todas las poblaciones habían experimentado un deterioro de las funciones metabólicas que no utilizaban después de 20 000 generaciones, restringiendo el rango de substancias con las cuales la bacteria podía crecer. Su análisis sugirió que este deterioro se debía a pleiotropía antagonística en la cual mutaciones que mejoraban la habilidad de crecer en glucosa habían reducido o eliminado la habilidad de crecer en otras substancias.[24] Un estudio posterior por Leiby y Marx que utilizó técnicas avanzadas mostraron que mucho del deterioro que Cooper y Lenski habían identificado eran artefactos experimentales, que la pérdida de funciones no utilizadas no era extensiva como habían visto al principio y que algunas de las funciones no utilizadas habían mejorado. Además concluyeron que las pérdidas metabólicas no se debían a pleiotropía antagonística, sino a la acumulación de mutaciones en porciones no utilizadas del genoma, sugiriendo que la adaptación a un ambiente no necesariamente conduce a la especialización.[25] Evolución de polimorfismo equilibrado y ecosistemas simplesDos variantes diferentes, S y L, se identificaron en la población designada como Ara-2 a 18 000 generaciones con base en la formación de pequeñas y grandes colonias, respectivamente.[26] Clones de las variantes S y L no podían coexistir de forma estable entre ellas, indicando que ocupaban diferentes nichos en la población. Este fue constatado por el descubrimiento de que la variante L tenía una ventaja en el crecimiento en glucosa, pero S tenía una ventaja durante la fase estacionaria, después de que la glucosa se había agotado. Las dos variantes fueron encontradas que habían evolucionado inicialmente antes de las 6000 generaciones, y coexistido desde entonces.[26] Análisis filogenético de los clones de las dos variantes aisladas de diferentes generaciones demostraron que S y L pertenecían a diferentes linajes coexistentes en la población y podían estar sufriendo especiación incipiente.[27] Evolución del uso aeróbico de citrato en una poblaciónAntecedentes Normalmente, E. coli es incapaz de crecer aeróbicamente en citrato debido a la inhabilidad de expresar un transportador de citrato en presencia de oxígeno.[29] Sin embargo, E. coli tiene un ciclo de ácido cítrico completo y por lo tanto puede metabolizar el citrato como un intermediario durante el crecimiento aeróbico en otras substancias, incluyendo glucosa. La mayoría de E. coli puede crecer anaeróbicamente en citrato vía fermentación, si un cosustrato como la glucosa es accesible y provee de poder reductivo.[5][29][30][31] El crecimiento anaeróbico es posible debido a la presencia de una gen antiportador de citrato-sucinato transmembranal, citT, el cual fue identificado por primera vez en 1998. Este gen es coregulado con otros genes involucrados en la fermentación de citrato encontrados en el operón cit, el cual se activa solamente en ausencia de oxígeno.[29][32] La incapacidad de crecer anaeróbicamente en citrato, referida como fenotipo Cit−, es considerada como una característica de la especie de E. coli, y una que ha sido una forma de diferenciar E. coli del patógeno Salmonella. Mientras que cepas de E. coli Cit+ han sido aisladas del ambiente y muestras agrícolas, en todos los casos, el carácter fue encontrado que se debía a la presencia de un plásmido que contiene un transportador de citrato foráneo.[33] Un único mutante de E. coli espontáneamente Cit+ fue reportado por Hall en 1982.[34] Este mutante había sido aislado durante la selección prolongada de otra nueva substancia para crecer en un caldo que también contenía citrato. En análisis genético de Hall indicó que la mutación subyacente era compleja, pero fue finalmente incapaz de identificar los cambios precisos o genes involucrados llevándolo a hipotetizar la activación de un gen trasnportador oculto.[34] Las regiones del genoma a las cuales pudo Hall limitar como lugares de cambios no corresponded a la posición conocida del gen citT identificado 16 años después, y tampoco las características fisiológicas en los ensayos de Hall transporte de los mutantes Cit+ se parecen a las que se esperan de la expresión aeróbica del transportador CitT.[33][35] Cit+ evoluciona en el LTEEEn 2008, el equipo de Lenski, dirigido por Zachary D. Blount, reportó que la habilidad de crecer aeróbicamente en citrato había evolucionado en una población. Cerca de la generación 33,127, se observó un incremento dramático en la población designada como Ara-3. Encontraron que la población contenía clones que eran capaces de crecer aeróbicamente en citrato (Cit+). Esta capacidad metabólica permitió a la población crecer varias veces más grande de lo que lo había hecho previamente, debido a las grandes cantidades de citrato presentes en el medio. Análisis de muestras fósiles congeladas de las poblaciones mostraban que los clones Cit+ se podían aislar desde las 31 500 generaciones. Las variantes Cit+ en la población tenían una gran cantidad de marcadores genéticos únicos a la población de Ara-3, lo que excluía la posibilidad de que fueran contaminates, en vez de mutantes espontáneos. En una serie de experimentos que "reprodujeron" la cinta de la evolución de Ara-3 a partir de clones Cit- aislados de muestras congeladas en diferentes momentos en la historia de la población, se demostró que la habilidad para crecer aeróbicamente en citrato era más posible que volviera a evolucionar en un grupo de clones evolucionados genéticamente puros. En estos experimento, observaron 19 instancias nuevas e independientes de la evolución de Cit+, pero solamente cuando empezaban con clones aislados después de la generación 20 000. Pruebas de fluctuación mostraron que los clones de esta generación y posteriores tenían una velocidad de mutación del carácter Cit+ significativamente más alta que la velocidad ancestral. Inclusive en esos clones posteriores, la velocidad de mutación de Cit+ estaba en el orden de una ocurrencia por cada trillón de divisiones celulares.[5] Lenski y sus compañeros concluyeron que la evolución de la función Cit+ en esta población en partiular surgió debido a una o más mutaciones previas, posiblemente no adaptativas, "potenciadoras" que incrementaron la velocidad de mutación a un nivel accesible. La información sugiere que el uso del citrato involucró al menos dos mutaciones subsecuentes a esas mutaciones "potenciadoras". Más generalmente, los autores sugieren que los resultados indican, siguiendo el argumento de Stephen Jay Gould, "que la contingencia histórica puede tener un profundo y duradero impacto" en el curso de la evolución.[5] Estos resultados han sido considerados como una instancia significativa del impacto de la contingencia histórica sobre la evolución.[11][36][37] Análisis genómico del carácter Cit+ e implicaciones de la innovación evolutivaEn 2012, Lenski y sus compañeros reportaron los resultados de un análisis genómico del carácter Cit+ que dio luz a la base genética e historia evolutiva del carácter. Los investigadores habían secuenciado el genoa completo de 29 clones aislados en diferentes periodos de la historia de la población Ara-3. Utilizaron estas secuencias para reconstruir la historia filogenética de la población, la cual mostraba que la población se había diversificado en tres clados a las 20 000 generaciones. La variante Cit+ había evolucionado en uno de estos al que llamaron Clado 3. Clones que habían sido identificados como potenciados en un estudio anterior se distribuían entre los tres clados, pero eran sobrerrepresentados Clado 3. Esto condujo a que los investigadores concluyeran que había habido por lo menos tres mutaciones potenciadoras involucradas en la evolución de Cit+.[6] Los investigadores también encontraron que todos los clones Cit+ tenían mutaciones duplicadas de un segmento de 2933 pares de bases involucrado en el gen de la proteína transportadora de citrato utilizada en el crecimiento anaeróbico en citrato, citT. La duplicación es tandem y resultó en dos copias en línea y juntas. La duplicación inmediatamente proporcionaba el carácter Cit+ por alterar la regulación donde el gen normalmente apagado citT es puesto bajo el control del promotor para un gen adyacente llamado rnk. El nuevo promotor activa la expresión del transportador de citrato cuando hay oxígeno presente y por lo tanto permite el crecimiento aeróbico en citrato.[6] El movimiento de este módulo rnk-citT en el genoma de un clon Cit− potenciado fue demostrado que era suficiente para producir un fenotipo Cit+. Sin embargo, el fenotipo Cit+ inicial proporcionado por la duplicación era muy débil y solo daba una aptitud benéfica de ~1%. Los investigadores encontraron que el número de copias del módulo rnk-citT tenía que ser incrementado para fortalecer el carácter Cit+ lo suficiente para permitir que la bacteria creciera bien en citrato. Mutaciones adicionales después de que la bacteria Cit+ fuera dominante en la población continuaron acumulándose para mejorar el crecimiento en citrato. Los investigadores concluyeron que la evolución del carácter Cit+ ocurrió en tres fases diferentes en donde las mutaciones acumuladas aumentaron la velocidad de mutación de Cit+, el carácter mismo apareció de forma débil y, finalmente, el carácter fue mejorado por mutaciones posteriores. Blount et al. sugirió que este patrón puede ser típico de cómo nuevos caracteres evolucionan en general y propuso un modelos de tres pasos para la innovación evolutiva:
Este modelo ha sido aceptado en biología evolutiva. En 2015, el paleontólogo Douglas Erwin sugirió una modificación hacia un modelo de cuatro pasos que refleje mejor la diferencia entre novedad evolutiva e innovación evolutiva, y resalte la importancia de las condiciones del ambiente: potenciación, generación de fenotipos nuevos (actualización), refinamiento adaptativo y explotación (conversión de una novedad a una innovación mientras se vuelve más importante para el establecimiento ecológico de los organismos poseedores).[38] Investigación de potenciaciónEn 2014, un equipo de investigación dirigido por Eric Quandt en el laboratorio de Jeffrey Barrick en la Universidad de Texas en Austin describió la aplicación de una nueva técnica llamada recombinación y secuenciación recursiva de todo el genoma (REGRES por sus siglas en inglés de Recursive Genomewide Recombination and Sequencing) para identificar mutaciones potenciadoras dentro de las 70 presentes en el linaje Ara-3 que evolucionó Cit+.[39] Este método usa múltiples rondas de un proceso en donde conjugación basada en plásmidos F a 33 000 generation Cit+ clone, CZB154, and the Cit- founding clone of the LTEE to purge mutations not required for either manifestation of a weak or strong form of the Cit+ trait, which they refer to as Cit++. Encontraron que el módulo rnk-citT responsable el cambio fenotípico Cit+ era suficiente para producir un fenotipo débil Cit+ en el ancestro. Ellos también identificaron una mutación que ocurrió en el linaje conduciendo a CZB154 después de la evolución inicial de Cit+ que proporcionó un fenotipo fuerte Cit++ en el ancestro sin mutaciones excepto en el módulo rnk-citT. Esta mutación, encontrada en una región reguladora de un gen llamado dctA, causó un aumento masivo en la expresión del transportador DctA, el cual funciona para importar dicarboxilatos C4 a la célula y había ocurrido en el linaje que lo condujo. Este aumento en la expresión DctA permite células Cit+ retomar sucinato, malato y fumarato liberado al medio por el transportador CitT durante el importe de cirato. Identificaron una mutación similar en clones Cit++ en la población Ara-3 que aumentó la expresión DctA restaurando la función a un gen que lo regula, dcuS, que había sido desactivado en el clon ancestral. Quandt et al. concluyeron que la mutación dctA no era involucrada en la potenciación, sino en el refinamiento. Esto los condujo a sugerir que la evolución de Cit+ en la población Ara-3 pudo haber sido contingente de un perfil genético y ecología específica de la población que permitió las variantes tempranas y débiles Cit+ a mantenerse en la población lo suficiente para refinar mutaciones que surgieran y hacer el crecimiento en citrato suficientemente fuerte para proveer una aptitud significativamente benéfica. Quandt y sus compañeros publicaron más tarde los resultados identificando definitivamente una mutación que potenció la evolución Cit+.[40] Esta mutación era un el gen gltA, el cual codifica la citrato sintasa, una enzima en el flujo del carbono al ciclo del ácido cítrico. Tenía el efecto de aumentar la actividad de la citrato sintasa y demostraron que permitía el crecimiento mejorado en acetato. Además, con la mutación gltA, el módulo rnk-citT que causa el carácter Cit+, tiene un efecto de neutral a benéfico en la aptitud, mientras que sin ella, el módulo era fuertemente perjudicial. La mutación gltA, por lo tanto, parece haber permitido a las variantes tempranas y débiles Cit+ a mantenerse en la población hasta que mutaciones refinadoras pudieran ocurrir, consistente con conclusiones anteriores. Después de que evolucionó el fenotipo fuerte Cit++, la actividad citrato sintasa se volvió perjudicial. Los investigadores encontraron que mutaciones posteriores en gltA se oponían a la primera mutación, reduciendo la actividad de la citrato sintasa y mejorando más el crecimiento en citrato. Concluyeron que las series e mutaciones en gltA primero potenciaron y después refinaron el crecimeinto en citrato. También sugirieron que el linaje en el cual Cit+ surgió pudo haber ocupado un nicho en Ara-3 basándose en el crecimiento en acetato y las mutaciones potenciadoras que condujeron a la evolución de Cit+ en Ara-3 eran originalmente adaptadoras para el uso de acetato. Investigación de la ecología post-Cit+ y diversidad persistenteUna pequeña subpoblación de células Cit- incapaz de crecer en citrato y pertenecientes a un clado separado se mantenía en la población después de que células Cit+ se volvieran dominates. Estudios anteriores mostraron que la diversidad se debía en parte a que las células Cit- eran mejores creciendo con la glucosa del medio.[5] Turner et al. encontró más tarde que otro factor detrás de la coexistencia fue que las células Cit- evolucionaron la habilidad de la alimentación cruzada con la mayoría Cit+. Mostraron que las células Cit+ liberaban sucinato, malato y fumarato durante el crecimiento en citrato ya que el transportador CitT bombea estas sustancias fuera de la célula mientras perite el paso del citrato a la célula. Las células Cit- evolucionaron rápidamente la habilidad de crecer en estas sustancias debido a una mutación que restauró la expresión de una proteína transportadora apropiada que estaba apagada en el ancestro.[41] La subpoblación Cit- eventualmente se extinguió en la población entre las 43 500 y 44 000 generaciones. Esta extinción se demostró que no se debía a la mayoría Cit+ evolucionando para invadir el nicho ocupado por la minoría Cit-. En efecto, clones Cit- podían invadir las poblaciones Cit+ después del evento de extinción. Además, en un experimento en donde volvieron a comenzar veinte réplicas de la población Ara-3 a partir de una muestra congelada 500 generaciones antes de la extinción, Turner et al. encontraron que la subpoblación Cit- no se había extinguido en ninguna de las réplicas después de 500 generaciones de evolución. Una de esas réplicas fue continuada por 2500 generaciones, durante las cuales Cit- continuó coexistiendo. Los investigadores concluyeron que la extinción de Cit- se había debido a alguna "rara perturbación ambiental" desconocida, similar a lo que puede afectar a poblaciones naturales.[42] La réplica final fue integrada al LTEE volviéndose la población decimotercera, Ara-7.[43] Críticas a los resultados del uso de citratoOtros investigadores han experimentado hacer evolucionar E. coli aerobio que use citrato. Dustin Van Hofwegen et al., trabajando en el laboratorio de Scott Minnich, fue capaz de aislar 46 mutantes independiente de E. coli que utilice citrato en solo de 12 a 100 generaciones usando selección altamente prolongada en hambruna, durante la cual la bacteria probaría más mutaciones más rápido.[44] En su estudio, el ADN genómico secuenciado demostró una amplificación de los loci citT y dctA y el reordenamiento de ADN era el de la misma clase de mutaciones identificadas en el experimento por Richard Lenski y su equipo. Ellos concluyeron que la rareza del mutante que usa citrato en el estudio de Lenski era posiblemente un resultado de condiciones experimentales selectivas usadas por su equipo en vez de ser un evento único de especiación evolutiva.[44] John Roth y Sophie Maisnier-Patin revisaron ambas perspectivas tanto en las mutaciones tardadas del equipo de Lenski como en las mutaciones rápidas del equipo de Van Hofweges en E. coli. Argumentan que ambos equipos experimentaron la misma secuencia de potenciación, actualización y refinamiento llevando a variantes similares de Cit+.[45] Según ellos, el periodo de menos de un día durante el cual el uso de citrato estaría bajo selección, seguido de una dilución 100 veces mayor y un periodo de crecimiento en glucosa que no sería selectivo para el uso de citrato, ultimadamente disminuía la probabilidad de que E. coli pudiera acumular mutaciones adaptativas tempranas de un periodo de selección al siguiente.[45] Por el otro lado, el equipo de Van Hofwegen permitió una selección continua en un periodo de 7 días lo que producía en desarrollo más rápido de E. coli que usara citrato. Roth y Maisnier-Patin sugirieron que la dilución seriada de E. coli y el periodo corto de selección para el uso de citrato bajo las condiciones del LTEE impidieron constantemente que cada generación de E. coli alcanzara las siguientes etapas del uso aeróbico de citrato.[45] Como respuesta, Blount y Lenski reconocieron que el problema no era con el experimento o con la información, sino con la interpretación hecha por Van Hofwegen et al. y Maisnier-Patin y Roth.[46] Lenski dijo que la evolución rápida de Cit+ no era necesariamente inesperada pues su equipo también había sido capaz de producir múltiples mutantes de Cit+ en pocas semanas durante los experimentos de reproducción que reportaron en el artículo de 2008 en donde su equipo describió la evolución del uso aeróbico de citrato en.[47] Además, Lenski criticó la descripción de Van Hofwegen et al. de la evolución inicial de Cit+ como un "evento de especiación" señalando que el LTEE no había sido diseñado para aislar mutantes que utilicen citrato o para hacer frente a la especiación desde que en el artículo de 2008 dijeron "que volviéndose Cit+ solo fue el primer paso en el camino a una posible especiación", y por lo tanto no proponían que los mutantes Cit+ eran una especie diferente sino que la especiación podría ser una consecuencia eventual de la evolución del carácter.[47] Lenski reconoce que los científicos, incluyéndose y a su equipo, utilizan comúnmente abreviaciones y jerga al discutir la especiación, en vez de escribir ás cuidadosamente y precisamente sobre el tema y esto puedo provocar conflictos.[47] Sin embargo, él dice que la especiación es generalmente considerada por biólogos evolutivos como un proceso y no un evento.[47] También critica a Van Hofwegen et al. y a Roth y Maisnier-Patin por postular "falsas dicotomías" sobre el concepto complejo de contingencia histórica. El argumenta que la contingencia histórica significa que la historia importa, y que el artículo de 2008 presentó información que mostraba que la evolución de Cit+ en el LTEE era contingente con las mutaciones que se habían acumulado antes. El concluye que "...contingencia histórica fue recurrida a y demostrada en un contexto específico, es decir que el surgimiento de Cit+ en el LTEE—no significa que el surgimiento de Cit+ es históricamente contingente en otros contextos experimentales, ni que otros cambios en el LTEE son históricamente contingente—de hecho, algunos otros cambios evolucionados en el LTEE han sido altamente predecibles y no (o por lo menos no obviamente) contingentes en mutaciones previas en las poblaciones".[47] Véase tambiénReferencias
Bibliografía adicional
Enlaces externos
|