|
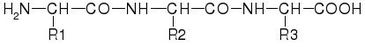
Estructura primaria de las proteínas La estructura primaria es la secuencia de aminoácidos de una cadena polipeptídica.[1] Esta secuencia se escribe desde el grupo amino-terminal hasta el carboxi-terminal, de acuerdo con el orden en que se sintetizan las proteínas por el ribosoma. Los aminoácidos están unidos de manera covalente por medio de enlaces peptídicos. Debido a que la formación del enlace peptídico ocurre por una reacción de condensación, se desprende una molécula de agua, producto del -OH del carboxilo y de un -H del grupo amino, y se habla propiamente de la secuencia de residuos de aminoácidos (o simplemente residuos).La cadena principal está formada por la sucesión de enlaces peptídicos que forma una columna vertebral de la cadena polipeptídica. El primer residuo tiene su grupo α-NH2 libre y el último residuo tiene su grupo α-COOH libre. Así se establecen el extremo N-terminal y C-terminal, con el que inicia y termina la secuencia de residuos. La forma de plegamiento, y por lo tanto la función de la cadena polipeptídica está determinada por la secuencia de los residuos. La secuencia de aminoácidos determina los otros niveles estructurales y las propiedades de cada polipéptido, debido a que las cadenas laterales de cada aminoácido presentan propiedades físico-químicas particulares. Por ello, los aminoácidos interactúan por fuerzas de atracción intermoleculares diversas con el agua, los compuestos hidrofóbicos y las cadenas laterales de aminoácidos cercanos. La estructura primaria constituye la forma más básica para describir a las proteínas. Los otros niveles de estructura de las proteínas son la estructura secundaria y la estructura terciaria. La asociación de varias cadenas polipeptídicas que resulta en una proteína funcional origina un nivel superior de organización, la llamada estructura cuaternaria. Cuando una proteína se somete a hidrólisis quedan en libertad los aminoácidos que constituyen a este, los cuales pueden ser identificados en una cantidad determinada.[2] Entre la estructura primaria y la forma tridimensional de las proteínasLa secuencia de aminoácidos de una cadena polipeptídica determina el tipo de interacciones no covalentes que se producirán (tanto entre la misma proteína como con su entorno) y el grado de libertad de adoptar diferentes conformaciones estables a una temperatura fisiológica. Algunos efectos de determinados aminoácidos sobre la estructura de la cadena son:
Modificaciones postraduccionalesAlgunos residuos laterales de aminoácidos en ciertas proteínas son modificados luego de la traducción por acetilación, metilación, carboxilación, Hidroxilación, Glucosilación y Fosforilación, entre otros, cambiándose las propiedades electrónicas de los mismos. Algunos ejemplos son: Por qué conocer la estructura primaria de las proteínasConocer la estructura primaria de una proteína es importante para entender su función (ya que ésta depende de la secuencia de aminoácidos y de la forma que adopte), así como en el estudio de enfermedades genéticas. Es posible que el origen de una enfermedad genética radique en una secuencia anormal. Esta anomalía, si es severa, podría resultar en que la función de la proteína no se ejecute de manera adecuada o, incluso, que no se ejecute en lo absoluto. A su vez, el estudio comparativo de la estructura primaria de las proteínas en organismos de diferentes especie, permite identificar patrones evolutivos a nivel molecular.[3] Las diferencias entre las secuencias de una dos o más proteínas que tienen funciones idénticas o similares pueden ser producto de la selección natural o de otros mecanismos evolutivos (como la deriva génica o evolución neutralista). Por otro lado, las secuencias conservadas usualmente corresponden con regiones estructural o funcionalmente esenciales para la función biológica de dichas proteínas. A partir de estos estudios, se establecen familias de proteínas. Deducción de la estructura primariaLa secuencia de aminoácidos está especificada en el ADN por la secuencia de nucleótidos. Existe un sistema de conversión, llamado código genético, que se utiliza para deducir la secuencia de aminoácidos de una cadena polipeptídica a partir de la secuencia de nucleótidos del gen. Sin embargo, ciertas modificaciones durante la transcripción del ADN, producidas por el splicing o corte y empalme alternativo no siempre permiten que esta conversión pueda hacerse directamente. Para obtener la secuencia de aminoácidos a partir de una muestra purificada de proteína, se recurre a métodos como la técnica de secuenciación a partir del N-terminal por degradación de Edman, o la fragmentación de la cadena en péptidos pequeños y su posterior identificación por espectrometría de masas. Efecto de las mutaciones genéticas sobre la estructura primaria de las proteínasLas mutaciones genéticas de tipo puntual pueden alterar la secuencia de aminoácidos de la cadena polipeptídica. Estas modificaciones pueden producir:
Otro tipo de mutaciones, como la deleción, inserción, duplicación, e inversión producen generalmente proteínas alteradas en el tamaño (más grande o menor, dependiendo la región del gen donde ocurrió la mutación) o la estructura tridimensional o ambos. En casi todos estos casos, las proteínas aberrantes conducen a problemas fisiológicos severos. Véase también
Referencias
Bibliografía
|