|
Dolor en los animales En los seres humanos, el dolor es una sensación desagradable, a menudo causada por estímulos dañinos o intensos. En los animales no humanos, el dolor es un tema polémico. La medida estándar de dolor en los seres humanos depende de cómo éstos lo comunican, por ejemplo en una escala de evaluación de dolor. Según la Asociación Internacional para el Estudio del Dolor, se define como «una experiencia sensorial y emocional desagradable asociada a una lesión tisular real o potencial, o descrita en términos de tal daño».[1] Solo el individuo que experimenta el dolor puede conocer la calidad e intensidad de éste y el grado de sufrimiento. Sin embargo, entre animales no humanos, es más difícil, siquiera posible, constatar si se ha producido una experiencia emocional.[2] Por lo tanto, tal concepto de dolor es a menudo excluido de las definiciones de dolor en animales, tales como la proporcionada por M Zimmerman: “una experiencia sensorial adversa causada por una lesión real o potencial que provoca la protección del motor y las reacciones vegetativas, resultando en aversión aprendida y que puede modificar comportamientos específicos de las especies, incluyendo el comportamiento social.”[3] Los animales no humanos no pueden informar acerca de sus sensaciones de la misma manera que lo hace la comunicación humana, pero la observación de su comportamiento proporciona un indicio razonable en cuanto a la magnitud de su dolor, tal como los médicos que, si bien no comparten el léxico profesional con sus pacientes, aun así pueden entender los indicadores de dolor que éstos transmiten. Según el Comité del Consejo de Investigación Nacional sobre Reconocimiento y Aplacamiento del Dolor en Animales de Laboratorio de EE. UU., el dolor es experimentado por muchas especies animales, incluyendo mamíferos y posiblemente todos los vertebrados.[4] Experiencia del dolorAunque hay numerosas definiciones de dolor, casi todas implican dos componentes claves. En primer lugar, se requiere la nocicepción.[5] Esta es la capacidad de detectar estímulos nocivos que provocan un reflejo como respuesta, el cual hace apartar rápidamente al animal entero, o a la parte afectada de su cuerpo, del origen del estímulo. El concepto de nocicepción no implica ninguna sensación subjetiva, sino un reflejo. Un ejemplo en los humanos sería el rápido retiro de un dedo que ha tocado algo caliente. El retiro se produce antes que se experimente realmente cualquier sensación de dolor. El segundo componente es la experiencia del dolor en sí mismo o sufrimiento –la interpretación interna y emocional de la experiencia nociceptiva. Una vez más en humanos, esto ocurre cuando el dedo retirado empieza a doler momentos después del retiro. El dolor es, por lo tanto, una experiencia interna, emocional. El dolor no puede ser medido en otros animales, incluyendo otros humanos. Las respuestas a estímulos dolorosos supuestamente pueden medirse, pero no la propia experiencia. Para hacer frente a este problema cuando se evalúa la capacidad de otras especies de experimentar dolor, se utiliza el argumento por analogía. Esto se basa en el principio de que si un animal responde a un estímulo de una manera similar a nosotros mismos, es probable que hayan tenido una experiencia análoga. Nocicepción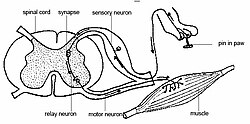 La nocicepción usualmente involucra la transmisión de una señal a lo largo de una cadena de fibras nerviosas desde el sitio del estímulo nocivo en la periferia hacia la médula espinal en el cerebro. Este proceso evoca una respuesta arco reflejo generada en la médula espinal y que no involucra al cerebro, tal como el pestañeo o el retiro de una extremidad. La nocicepción se encuentra, en una forma u otra, en todos los principales taxones de animales.[5] La nocicepción puede ser observada usando modernas técnicas de imagen; asimismo respuestas fisiológicas y de comportamiento hacia la nocicepción pueden ser detectadas. DolorLos impulsos nerviosos de la respuesta nociceptiva pueden ser conducidos al cerebro el cual registra la ubicación, intensidad, calidad y desagrado del estímulo. El componente subjetivo del dolor implica el conocimiento consciente y desagradable de la sensación. Los procesos cerebrales que subyacen en la percepción consciente del desagrado (sufrimiento) no han sido completamente entendidos. Muchos animales también presentan cambios fisiológicos y de comportamiento más complejos, los cuales indican la capacidad de experimentar dolor: comen menos comida, su comportamiento normal se altera, su comportamiento social es suprimido, pueden adoptar patrones de comportamiento inusuales, pueden emitir llamadas de socorro, experimentan cambios cardiovasculares y respiratorios, así como inflamación y liberación de hormonas de estrés.[6] Algunos criterios que pueden indicar la capacidad potencial de otras especies de sentir dolor, incluyen:[7]
Argumento por AnalogíaPara tratar el problema de la evaluación de la capacidad de otras especies de experimentar el estado afectivo del dolor (sufrimiento), se recurre al argumento por analogía. Esto se basa en el principio de que si un animal responde a un estímulo de manera similar a nosotros mismos, es probable que hayan tenido una experiencia análoga. Si clavamos un alfiler en el dedo de un chimpancé y este retira rápidamente su mano, usamos el argumento por analogía e inferimos que, al igual que nosotros, sintió dolor. Son la misma coherencia también hay que inferir que una cucaracha experimenta lo mismo cuando se retuerce luego de haber sido pinchada con el alfiler.[8] De manera análoga a los humanos, cuando se les da a elegir la comida, ratas[9] y pollos[10] con síntomas clínicos de dolor consumen los alimentos con mayor contenido analgésico que sus pares sin dolor. Asimismo, el consumo del analgésico carprofeno en pollos de engorde cojos, se relacionó positivamente con la gravedad de la cojera, y el consumo resultó en un mejor estado. Ciertas limitaciones del argumento por analogía yacen en que las reacciones físicas no pueden ni determinar ni ser motivadas por estados mentales, y la aproximación está sujeta a la crítica de ser considerada antropomorfa. Por ejemplo, un organismo unicelular como la ameba puede retorcerse luego de haber sido expuesta a estímulos nocivos a pesar de la ausencia de nocicepción. HistoriaLa idea según la cual los animales no pueden experimentar el dolor o el sufrimiento como lo hacen los humanos se remonta al menos al filósofo francés del siglo XVII René Descartes, quien sugería que los animales carecen de consciencia.[11][12][13] Los investigadores permanecieron inseguros hasta la década de 1980 acerca de si los animales experimentan el dolor, y a los veterinarios entrenados en los EEUU hasta 1989 simplemente se les indicaba ignorar el dolor animal.[14] En sus interacciones con científicos y otros veterinarios, el filósofo estadounidense Bernard Rollin era regularmente cuestionado a “probar” que los animales eran conscientes y a proveer bases “científicamente aceptables” para declarar que pueden sentir dolor.[14][11][15] Algunos investigadores señalan que la postura según la cual el dolor animal es diferente es hoy en día una postura minoritaria.[11] Las opiniones académicas sobre el tema son más ambiguas, notando que, pese a que es probable que algunos animales tengan al menos simples pensamientos y sentimientos conscientes,[15] algunos autores siguen cuestionando cómo se pueden determinar de forma fiable los estados mentales de los animales.[12][16] En diferentes especiesLa habilidad de experimentar dolor en un animal, u otro ser humano en el mismo aspecto, no puede ser determinada directamente, pero puede ser inferida a través de reacciones fisiológicas y de comportamiento análogas.[17] Aunque muchos animales comparten mecanismos similares de detección de dolor a los de los seres humanos, tienen áreas similares del cerebro implicadas en el procesamiento del dolor, y muestran comportamientos similares hacia el dolor, es notoriamente difícil evaluar cómo los animales en realidad experimentan el dolor.[6] NocicepciónLos nervios nociceptivos, que preferentemente detectan estímulos lesivos (potenciales), se han identificado en una variedad de animales, incluyendo los invertebrados. La sanguijuela medicinal, hirudo medicinalis y la babosa de mar son sistemas de modelos clásicos para el estudio de la nocicepción. Muchos otros animales vertebrados e invertebrados asimismo muestran respuestas reflejo nociceptivas similares a las nuestras. VertebradosPecesUn nervio cutáneo humano típico contiene 83 % receptores de tipo C de trauma (el tipo responsable de transmitir señales descritas por los seres humanos como dolor insoportable); los mismos nervios en humanos con insensibilidad congénita al dolor tienen sólo 24-28 % receptores de tipo C.[18] La trucha arco iris tiene aproximadamente un 5 % de fibras de tipo C, mientras que los tiburones y rayas tienen 0%.[19] Sin embargo, en el pescado se ha demostrado que tienen las neuronas sensoriales que son sensibles a los estímulos nocivos y son fisiológicamente idénticos a los nociceptores humanos.[20] Las respuestas fisiológicas y de comportamiento a un acontecimiento doloroso parecen ser comparables a las observadas en los anfibios, aves y mamíferos, y la administración de un fármaco analgésico reduce estas respuestas en el pez.[21] Los defensores del bienestar animal han expresado su preocupación por el posible sufrimiento de peces causado por la pesca. Algunos países, por ejemplo, Alemania, han prohibido ciertos tipos de pesca, y la RSPCA británica ahora procesa formalmente a los individuos que son crueles con los peces. InvertebradosAunque se ha argumentado que la mayoría de los invertebrados no sienten dolor,[22][23][24] hay cierta evidencia de que algunos, especialmente los crustáceos decápodos (por ejemplo, los cangrejos y las langostas) y cefalópodos (por ejemplo, pulpos), exhiben comportamientos y reacciones fisiológicas que indican que pueden ser capaces de experimentarlo.[8][25][26] Nociceptores han sido encontrados en los nematodos, anélidos y moluscos.[27] La mayoría de los insectos no poseen nociceptores,[28][29][30][31] siendo una excepción conocida la mosca de la fruta. En los vertebrados, los opioides endógenos son los neuroquímicos que moderan el dolor mediante la interacción con los receptores de opiáceos. Los péptidos opioides y los receptores de opiáceos son producidos de forma natural en nematodos,[32][33] moluscos,[34][35] insectos[36][37] y crustáceos.[38][39] La presencia de opioides en los crustáceos se ha interpretado como una indicación de que las langostas pueden ser capaces de experimentar dolor,[40] aunque se ha reivindicado que "Hasta ahora ninguna conclusión determinada se puede sacar”.[40] Una razón sugerida para rechazar la experiencia de dolor en invertebrados es que los cerebros de invertebrados son demasiado pequeños. Sin embargo, el tamaño del cerebro no necesariamente equivale a la complejidad de la función.[41] Por otra parte, el peso de peso corporal, el cerebro cefalópodo está en el mismo rango de tamaño que el cerebro de los vertebrados, más pequeño que el de las aves y los mamíferos, pero tan grande como o más grande que la mayoría de los cerebros de peces.[42][43] Desde septiembre de 2010, todos los cefalópodos siendo utilizados para fines científicos en la UE están protegidos por la Directiva de la UE 2010 / 63 / UE, que establece "...thehay evidencia científica de su capacidad cefalópodos a experimentar dolor, sufrimiento, angustia y daño duradero.[44] En el Reino Unido, la legislación sobre protección de los animales[45] determina que los cefalópodos utilizados para fines científicos deben ser sacrificados, de acuerdo con los métodos prescritos (conocidos como " Lista 1 métodos de eutanasia “) conocidos por minimizar el sufrimiento[46] En medicina e investigaciónMedicina veterinariaLa medicina veterinaria utiliza, para el dolor existente o potencial, los mismos analgésicos y anestésicos que se usan en humanos.[47] DolorimetríaDolorimetría es la medición de la respuesta al dolor en los animales, incluidos seres humanos. Se practica de vez en cuando en la medicina, como herramienta de diagnóstico, y se usa regularmente en investigación en ciencia básica de dolor, asimismo para probar la eficacia de los analgésicos. Técnicas de medición de dolor de los animales no humanos incluyen la prueba de presión de la pata, prueba de retiro de la cola, prueba de la placa caliente y escala de muecas. Animales de laboratorioLos animales se utilizan en los laboratorios por una amplia gama de razones, algunas de las cuales pueden implicar dolor, sufrimiento o angustia, mientras que otros (por ejemplo, muchos de los implicados en la reproducción) no. La medida en que la experimentación con animales causa dolor y el sufrimiento en los animales de laboratorio es un tema altamente polémico en la actualidad.[48] La bióloga Británica Marian Dawkins define "sufrimiento" en animales de laboratorio como la experiencia de "una amplia gama de estados subjetivos (mentales) extremadamente desagradables”.[49] El Consejo de Investigación Nacional de Estados Unidos ha publicado manuales sobre el cuidado y uso de animales de laboratorio,[50] así como un informe sobre el reconocimiento y aplacamiento del dolor en los vertebrados.[51] El Departamento de Agricultura de los Estados Unidos define los "procedimientos dolorosos" en estudios en animales como aquellos que "se espera que causen razonablemente un poco más que ligero dolor o malestar momentáneo en un ser humano."[52] Algunos críticos argumentan que, paradójicamente, los investigadores plantearon en la era de mayor conciencia de bienestar de los animales pueden estar inclinados a negar que los animales están en el dolor, simplemente porque no quieren verse a sí mismos como personas que infligen ella.[53] PETA sin embargo sostiene que no hay duda acerca de los animales en los laboratorios siendo infligidas por el dolor.[54] En el Reino Unido, la investigación con animales susceptibles de causar "dolor, sufrimiento, angustia o daño duradero" está regulada por la Ley de 1986 y de investigación Animales (Procedimientos científicos) con el potencial de causar dolor está regulada por el animal Ley de Bienestar de 1966 en los EE. UU. En los EE. UU., la Guía para el Cuidado y Uso de Animales de Laboratorio define los parámetros para las regulaciones de experimentación animal. Se manifiesta, "La capacidad de experimentar y responder al dolor está muy extendido en el reino animal ... El dolor es un factor de estrés y, si no se remedia, puede dar lugar a niveles inaceptables de estrés y angustia en los animales.""[55] La guía determina que la capacidad de reconocer los síntomas de dolor en diferentes especies es esencial para las personas que cuidan y hacen uso de los animales. En consecuencia, todos los problemas de dolor y angustia de los animales y su posible tratamiento con analgesia y anestesia, son problemas de regulación requeridos para la aprobación del protocolo animal. Escalas de gravedadOnce países tienen sistemas nacionales de clasificación del dolor y sufrimiento en animales utilizados en investigación: Australia, Canadá, Finlandia, Alemania, Irlanda, Países Bajos, Nueva Zelanda, Polonia, Suecia, Suiza y el Reino Unido. Los EE. UU. también tienen por mandato un sistema de clasificación nacional científica sobre el uso de animales, pero es muy diferente de otros países ya que éste informa si se requiere y/o se utilizan medicamentos para aliviar el dolor.[56] Las primeras escalas de gravedad fueron implementadas en 1986 por Finlandia y el Reino Unido. El número de categorías de gravedad oscila entre 3 (Suecia y Finlandia) y 9 (Australia). En el Reino Unido, los proyectos de investigación se clasifican como "leve", "moderado" y "importante" en términos del sufrimiento que puede causar el estudio según los investigadores; una cuarta categoría de "sin clasificar" significa que el animal fue anestesiado y matado sin recuperar la conciencia. Hay que recordar que en el sistema del Reino Unido, muchos proyectos de investigación (por ejemplo cría transgénica, alimentación con alimentos de mal sabor) requieren una licencia del Acta 1986 de Procedimientos Científicos en Animales, pero puede causar poco o ningún dolor o sufrimiento. En diciembre de 2001, el 39 por ciento (1296) de las licencias de proyectos en vigor fueron clasificados como "leve", el 55 por ciento (1811) como "moderado", el dos por ciento (63) como "importante", y 4 por ciento (139 ) como "sin clasificar".[57] En 2009, de las licencias de proyectos emitidos, el 35 por ciento (187) fueron clasificados como "leve", el 61 por ciento (330) como "moderado", el 2 por ciento (13) como "graves" y 2 por ciento (11) como sin clasificar.[58] En los Estados Unidos, la Guía para el Cuidado y Uso de Animales de Laboratorio define los parámetros para las regulaciones de experimentación animal. Se afirma, "La capacidad de experimentar y responder al dolor está muy extendida en el reino animal ... El dolor es un factor de estrés y, si no se remedia , puede dar lugar a niveles inaceptables de estrés y angustia en los animales."[55] La Guía manifiesta que la capacidad de reconocer los síntomas de dolor en diferentes especies es esencial para las personas que cuidan y utilizan animales. En consecuencia, todos los problemas de dolor y angustia en animales y su posible tratamiento con analgesia y anestesia,son regularmente requeridos para su aprobación por el protocolo animal. Véase también
Referencias
|