|
Determinación de constantes de equilibrio
se implica que el cociente de actividad es constante. Para que esta suposición sea válida, las constantes de equilibrio deben determinarse en un medio de fuerza iónica relativamente alta. Cuando esto no sea posible, se debe considerar la posible variación de la actividad. La expresión de equilibrio anterior es una función de las concentraciones [A], [B], etc. de la especie química en equilibrio. El valor constante de equilibrio puede determinarse si se puede medir cualquiera de estas concentraciones. El procedimiento general es que la concentración en cuestión se mide para una serie de soluciones con concentraciones analíticas conocidas de los reactivos. Típicamente, una titulación se realiza con uno o más reactivos en el recipiente de titulación y uno o más reactivos en la bureta. Al conocer las concentraciones analíticas de los reactivos inicialmente en el recipiente de reacción y en la bureta, todas las concentraciones analíticas se pueden derivar en función del volumen (o masa) del valorante agregado. Las constantes de equilibrio pueden derivarse ajustando mejor los datos experimentales con un modelo químico del sistema de equilibrio. Métodos experimentalesHay cuatro métodos experimentales principales.[1] Mediciones potenciométricasUna concentración libre [A] o actividad {A} de una especie A se mide por medio de un electrodo selectivo de iones como el electrodo de vidrio. Si el electrodo se calibra utilizando estándares de actividad, se supone que la ecuación de Nernst se aplica en la forma
donde E0 es el potencial de electrodo estándar. Cuando se utilizan soluciones tampón de pH conocido para la calibración, la lectura del medidor será un pH.
A los 298 K,1 la unidad de pH es aproximadamente igual a 59 mV.[2] Cuando el electrodo se calibra con soluciones de concentración conocida, por medio de una fuerte titulación ácido-fuerte, por ejemplo, se supone una ecuación de Nernst modificada.
donde s es un factor de pendiente empírico. Se puede preparar una solución de concentración conocida de iones de hidrógeno mediante la estandarización de un ácido fuerte contra el bórax. El ácido clorhídrico de ebullición constante también se puede usar como un estándar primario para la concentración de iones de hidrógeno. Mediciones espectrofotométricasAbsorbanciaSe supone que se aplica la ley de Beer-Lambert. donde l es la longitud del camino óptico, ε es una absorbancia molar a la longitud del camino unitario y c es una concentración. Más de una de las especies puede contribuir a la absorbancia. En principio, la absorbancia se puede medir solo en una longitud de onda, pero en la práctica actual es común registrar espectros completos. Fluorescencia (luminiscencia) intensidadSe supone que la intensidad de la luz dispersada es una función lineal de las concentraciones de las especies. donde φ es una constante de proporcionalidad. Mediciones de desplazamiento químico de RMNSe supone que el intercambio químico es rápido en la escala de tiempo de RMN. Un cambio químico individual es el promedio ponderado en fracciones molares de los cambios de núcleos en las especies contribuyentes. Ejemplo: la pKa del grupo hidroxilo en el ácido cítrico se determinó a partir de los datos de cambio químico del 13C como 14.4. Para esta determinación no se pudo utilizar potenciometría ni espectrofotometría UV visible.[3] Mediciones calorimétricasLa medición simultánea de K y ΔH para aductos 1:1 se realiza de forma rutinaria mediante calorimetría de titulación isotérmica. La extensión a sistemas más complejos está limitada por la disponibilidad de software adecuado. Rango y limitaciones
Métodos computacionalesSe supone que los datos experimentales recopilados comprenden un conjunto de puntos de datos. En cada i punto de datos, las concentraciones analíticas de los reactivos, TA(i) TB(i) etc son conocidos junto con una cantidad medida, yi que depende de uno o más de estas concentraciones analíticas. Un procedimiento computacional general tiene cuatro componentes principales:
El modelo químicoEl modelo químico consiste en un conjunto de especies químicas presentes en solución, tanto los reactivos agregados a la mezcla de reacción como las especies complejas formadas a partir de ellos. Denotando los reactivos por A, B..., cada especie compleja está especificada por los coeficientes estequiométricos que relacionan la combinación particular de reactivos que los forman.
Cuando se usan programas de computadora de propósito general, es usual usar constantes de asociación acumulativas, como se muestra arriba. Las cargas eléctricas no se muestran en expresiones generales como esta y, a menudo, se omiten en expresiones específicas, por simplicidad de notación. De hecho, las cargas eléctricas no tienen relación con los procesos de equilibrio, salvo que existe un requisito de neutralidad eléctrica general en todos los sistemas. Con las soluciones acuosas, las concentraciones de protón (ion hidronio) e ion hidróxido están limitadas por la autodisociación del agua.
Con las soluciones diluidas, la concentración de agua se supone constante, por lo que la expresión de equilibrio se escribe en forma del producto iónico del agua. Cuando tanto H + como OH - deben considerarse reactivos, uno de ellos se elimina del modelo especificando que su concentración se deriva de la concentración del otro. Normalmente la concentración del ion hidróxido viene dada por En este caso, la constante de equilibrio para la formación de hidróxido tiene los coeficientes estequiométricos -1 en relación con el protón y cero para los otros reactivos. Esto tiene implicaciones importantes para todos los equilibrios de protonación en solución acuosa y en particular para las constantes de hidrólisis. Es bastante habitual omitir en el modelo aquellas especies cuyas concentraciones se consideran insignificantes. Por ejemplo, generalmente se asume que no hay interacción entre los reactivos y / o complejos y el electrolito usado para mantener la fuerza iónica constante o el tampón usado para mantener el pH constante. Estas suposiciones pueden o no estar justificadas. Además, se asume implícitamente que no hay otras especies complejas presentes. Cuando los complejos se ignoran erróneamente, se introduce un error sistemático en los cálculos. Los valores constantes de equilibrio generalmente se estiman inicialmente por referencia a las fuentes de datos. Cálculos de especiaciónUn cálculo de especiación es uno en el que se calculan las concentraciones de todas las especies en un sistema de equilibrio, conociendo las concentraciones analíticas, TA, TB, etc., de los reactivos A, B, etc. Esto significa resolver un conjunto de ecuaciones no lineales de balance de masa. para las concentraciones libres [A], [B] etc. Cuando se mide el pH (o emf, E) equivalente, la concentración libre de iones de hidrógeno, [H], se obtiene del valor medido como
y solo se calculan las concentraciones libres de los otros reactivos. Las concentraciones de los complejos se derivan de las concentraciones libres a través del modelo químico. Algunos autores[4][5] incluyen los términos reactivos libres en las sumas al declarar constantes β identidad (unidad) para las cuales los coeficientes estequiométricos son 1 para el reactivo en cuestión y cero para todos los demás reactivos. Por ejemplo, con 2 reactivos, las ecuaciones de balance de masa toman la forma más simple. De esta manera, todas las especies químicas, incluidos los reactantes libres, se tratan de la misma manera, ya que se han formado a partir de la combinación de reactivos que se especifica mediante los coeficientes estequiométricos. En un sistema de titulación, las concentraciones analíticas de los reactivos en cada punto de titulación se obtienen de las condiciones iniciales, las concentraciones de bureta y los volúmenes. La concentración analítica (total) de un reactivo R en el punto i titulación viene dada por donde R 0 es la cantidad inicial de R en el recipiente de titulación, v0 es el volumen inicial, [R] es la concentración de R en la bureta y vi es el volumen agregado. La concentración de la bureta de un reactivo no presente en la bureta se toma como cero. En general, la resolución de estas ecuaciones no lineales presenta un desafío formidable debido al enorme rango en el que pueden variar las concentraciones libres. Al principio, los valores para las concentraciones libres deben ser estimados. Luego, estos valores se refinan, generalmente mediante iteraciones de Newton-Raphson. Los logaritmos de las concentraciones libres pueden ser refinados en lugar de las concentraciones libres en sí mismas. El refinamiento de los logaritmos de las concentraciones libres tiene la ventaja adicional de imponer automáticamente una restricción de no negatividad en las concentraciones libres. Una vez que se han calculado las concentraciones de reactante libre, las concentraciones de los complejos se derivan de ellas y las constantes de equilibrio. Tenga en cuenta que las concentraciones de reactantes libres pueden considerarse como parámetros implícitos en el proceso de refinamiento de la constante de equilibrio. En ese contexto, los valores de las concentraciones libres se ven limitados al obligar a que las condiciones de balance de masa se apliquen en todas las etapas del proceso. Equilibrio constante de refinamientoEl objetivo del proceso de refinamiento es encontrar valores constantes de equilibrio que den el mejor ajuste a los datos experimentales. Esto generalmente se logra minimizando una función objetivo, U, por el método de mínimos cuadrados no lineales. Primero se definen los residuos como Entonces la función objetivo más general es dada por La matriz de ponderaciones, W, debería ser, idealmente, la inversa de la matriz de varianza-covarianza de las observaciones. Es raro que esto se sepa. Sin embargo, cuando lo es, el valor esperado de U es uno, lo que significa que los datos se ajustan dentro del error experimental. La mayoría de las veces, solo se conocen los elementos diagonales, en cuyo caso la función objetivo se simplifica a con Wij = 0 cuando j ≠ i. Los pesos unitarios, Wii = 1 , se usan a menudo, pero, en ese caso, el valor esperado de U es el cuadrado medio de la raíz de los errores experimentales. La minimización se puede realizar utilizando el método de Gauss-Newton. En primer lugar, la función objetivo se linealiza aproximándola como una expansión de la serie de Taylor de primer orden sobre un conjunto de parámetros iniciales, p. Los incrementos δpi se agregan a los parámetros iniciales correspondientes, de modo que U es menor que U0. Como mínimo, los derivados ∂U∂pi , que están simplemente relacionados con los elementos de la matriz jacobiana, J donde pk es el parámetro k del refinamiento, son iguales a cero. Una o más constantes de equilibrio pueden ser parámetros del refinamiento. Sin embargo, las cantidades medidas (ver arriba) representadas por y no se expresan en términos de las constantes de equilibrio, sino en términos de las concentraciones de las especies, que son funciones implícitas de estos parámetros. Por lo tanto, los elementos jacobianos deben obtenerse mediante la diferenciación implícita. Los incrementos de los parámetros δp se calculan resolviendo las ecuaciones normales, derivadas de las condiciones que ∂U∂p = 0 como mínimo. Los incrementos δp se agregan iterativamente a los parámetros. donde n es un número de iteración. Las concentraciones de las especies ycalc valores de ycalc se recalculan en cada punto de datos. Las iteraciones se continúan hasta que no se logre una reducción significativa en U, es decir, hasta que se satisfaga un criterio de convergencia. Sin embargo, si los parámetros actualizados no producen una disminución de la función objetivo, es decir, si se produce una divergencia, el cálculo del incremento debe modificarse. La modificación más simple es usar una fracción, f , de incremento calculado, denominado corte de desplazamiento. En este caso, la dirección del vector de desplazamiento, δp, no se modifica. Con el algoritmo de Levenberg-Marquardt más poderoso, por otra parte, el vector de desplazamiento se gira hacia la dirección de mayor pendiente, modificando las ecuaciones normales, donde λ es el parámetro de Marquardt e I es una matriz de identidad. Se han propuesto otros métodos para manejar la divergencia.[5] Un problema particular surge con la RMN y los datos espectrofotométricos. Para este último, la cantidad observada es absorbancia, A, y la ley de Beer-Lambert se puede escribir como Se puede ver que, asumiendo que las concentraciones, c, son conocidas, que la absorbancia, A, a una longitud de onda dada, y longitud del camino , es una función lineal de las absorbptividades molares, ε. Con 1 cm de longitud de recorrido, en notación matricial. Existen dos enfoques para el cálculo de las absortividades molares desconocidas.
Errores de parámetros y correlaciónEn la región cercana al mínimo de la función objetivo, U, el sistema se aproxima a un sistema lineal de mínimos cuadrados, para el cual Por lo tanto, los valores de los parámetros son (aproximadamente) combinaciones lineales de los valores de los datos observados y los errores en los parámetros, p, se pueden obtener por propagación de error de las observaciones, yobs, usando la fórmula lineal. Deje que la matriz de varianza-covarianza para las observaciones se denote por Σy la de los parámetros por Σp. Entonces, Cuando W = (Σy)−1, esto se simplifica a En la mayoría de los casos, los errores en las observaciones no están correlacionados, de modo que Σy es diagonal . Si es así, cada peso debe ser el recíproco de la varianza de la observación correspondiente. Por ejemplo, en una titulación potenciométrica, el peso en un punto de titulación, k, puede ser dado por donde σE es el error en el potencial del electrodo o pH, (∂E∂v) Cuando se utilizan pesos unitarios ( W = I , p = (JTJ)−1JTy ), se da a entender que los errores experimentales no están correlacionados y son iguales: Σy = σ2I , donde σ2 se conoce como varianza de una observación de peso unitario, y I es una matriz de identidad. En este caso σ2 se aproxima por donde U es el valor mínimo de la función objetivo y nd y np son el número de datos y parámetros, respectivamente. En todos los casos, la varianza del parámetro pi viene dada por Σp Tenga en cuenta que aunque las observaciones pueden no estar correlacionadas, los parámetros siempre están correlacionados. Constantes derivadasCuando las constantes acumulativas se han refinado, a menudo es útil derivar constantes por pasos a partir de ellas. El procedimiento general es anotar las expresiones de definición para todas las constantes involucradas y luego igualar las concentraciones. Por ejemplo, supongamos que se desea obtener el pKa para eliminar un protón de un ácido tribásico, LH3, como el ácido cítrico. La constante de asociación paso a paso para la formación de LH3 está dada por Sustituye las expresiones por las concentraciones de LH3 y LH− De donde y como pKa = −log10 1K su valor viene dado por Note la numeración inversa para pK y log β. Al calcular el error en la constante escalonada, debe tenerse en cuenta el hecho de que las constantes acumulativas están correlacionadas. Por propagación de error y Selección de modeloUna vez que se haya completado un refinamiento, se deben verificar los resultados para verificar que el modelo elegido sea aceptable. En términos generales, un modelo es aceptable cuando los datos se ajustan a un error experimental, pero no hay un criterio único para usar para hacer el juicio. Lo siguiente debe ser considerado. La función objetivaCuando los pesos se han derivado correctamente de las estimaciones de error experimental, el valor de expectativa de Und − np es 1.[7] Por lo tanto, es muy útil estimar errores experimentales y derivar algunos pesos razonables de ellos, ya que es un indicador absoluto de la bondad del ajuste. Cuando se usan los pesos unitarios, se implica que todas las observaciones tienen la misma varianza. Se espera que Und − np sea igual a esa varianza. Errores de parámetrosUno querría que los errores en las constantes de estabilidad sean aproximadamente proporcionales al error experimental. Por ejemplo, con los datos de titulación del pH, si el pH se mide con 2 decimales, los errores de log10 β no deben ser mucho mayores que 0.01. En trabajos exploratorios donde la naturaleza de las especies presentes no se conoce de antemano, se pueden probar y comparar varios modelos químicos diferentes. Habrá modelos donde las incertidumbres en la mejor estimación de una constante de equilibrio pueden ser algo o incluso significativamente mayores que el σpH, especialmente con aquellas constantes que gobiernan la formación de especies comparativamente menores, pero la decisión de cuán grande es aceptable sigue siendo subjetiva. El proceso de decisión sobre si incluir o no equilibrios comparativamente inciertos en un modelo, y para la comparación de modelos competitivos en general, puede ser objetivo y ha sido descrito por Hamilton.[7] Distribución de residuos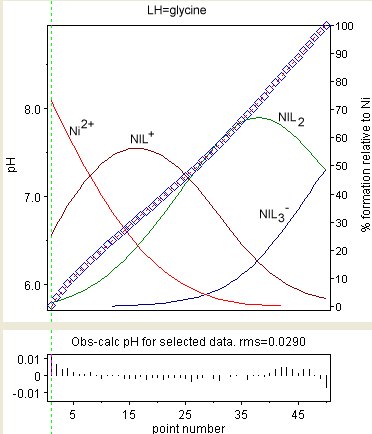 Como mínimo en U el sistema puede aproximarse a uno lineal, los residuos en el caso de pesos unitarios están relacionados con las observaciones por El simétrica, idempotente matriz J(JTT)−1J es conocido en la literatura estadística como la matriz de sombrero , H Así, y donde I es una matriz de identidad y Mr y My son las matrices de varianza-covarianza de los residuos y observaciones, respectivamente. Esto muestra que aunque las observaciones pueden no estar correlacionadas, los residuos siempre están correlacionados. El diagrama de la derecha muestra el resultado de un refinamiento de las constantes de estabilidad de Ni (Gly)+, Ni (Gly)2 y Ni(Gly)− Restricciones físicasAlgunas restricciones físicas son usualmente incorporadas en los cálculos. Por ejemplo, todas las concentraciones de reactantes libres y especies deben tener valores positivos y las constantes de asociación deben tener valores positivos. Con los datos espectrofotométricos, todos los valores de absortividad (o emisividad) molar deberían ser positivos. La mayoría de los programas de computadora no imponen esta restricción en los cálculos. Otros modelosSi el modelo no es aceptable, se debe examinar una variedad de otros modelos para encontrar el que mejor se ajuste a los datos experimentales, dentro del error experimental. La principal dificultad es con las llamadas especies menores. Estas son especies cuya concentración es tan baja que el efecto en la cantidad medida está en o por debajo del nivel de error en la medición experimental. La constante para una especie menor puede resultar imposible de determinar si no hay medios para aumentar la concentración de la especie. . ImplementacionesAlgunos sistemas simples son susceptibles de cálculos de hoja de cálculo.[8] Se ha publicado un gran número de programas de computadora para el cálculo de la constante de equilibrio.[9] Los programas más utilizados son:
Los calorímetros de titulación isotérmicos comerciales generalmente se suministran con un software con el que se puede obtener una constante de equilibrio y una entalpía de formación estándar para la formación de un aducto 1:1. También se puede suministrar algún software para manejar equilibrios más complejos. Referencias
|

![{\displaystyle K={\frac {\mathrm {[S]} ^{\sigma }\mathrm {[T]} ^{\tau }\cdots }{\mathrm {[A]} ^{\alpha }\mathrm {[B]} ^{\beta }\cdots }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7fbf3623d6284c219011f318e2197779ab194931)


![{\displaystyle E=E^{0}+s\log _{10}\mathrm {[A]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c404b52bc56775c11adfd79fab6c73166abc0193)






![{\displaystyle \beta _{pq\cdots }={\frac {[{\ce {A}}_{p}{\ce {B}}_{q}\cdots ]}{[{\ce {A}}]^{p}[{\ce {B}}]^{q}\cdots }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/41ddfaa95c2aab1288ee0ef5881d7829e498e933)

![{\displaystyle K_{\mathrm {W} }^{'}={\frac {[H^{+}][OH^{-}]}{[H_{2}O]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/31183901f208f67c181a1cbafa2c7d61b45f73e4)
![{\displaystyle K_{\mathrm {W} }={\ce {[H+]}}[{\ce {OH-}}]\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/29aa88810dddbd1cfe6122a3c8a3f27fe64d61f4)
![{\displaystyle [{\ce {OH-}}]={\frac {K_{{\ce {W}}}}{[{\ce {H+}}]}}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c6d83aeaec2578430ca83870deb9a3e00c622e4c)
![{\displaystyle {\begin{aligned}{\ce {T_{A}}}&=[{\ce {A}}]+\sum _{1,nk}p\beta _{pq\cdots }[{\ce {A}}]^{p}[{\ce {B}}]^{q}\cdots \\{\ce {T_{B}}}&=[{\ce {B}}]+\sum _{1,nk}q\beta _{pq\cdots }[{\ce {A}}]^{p}[{\ce {B}}]^{q}\cdots \\etc.\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2006c9c342b8217af7f3ad79e0218ca647bcf264)
![{\displaystyle [\mathrm {H} ]=10^{-\mathrm {pH} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8b22a1dc887dbdb859b455b86ddeea83cdd88106)
![{\displaystyle [\mathrm {H} ]=10^{\mathrm {\frac {E-E^{0}}{2.303RT/nF}} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/25c8fbe5d77db753c52da389b08f30179d2de934)
![{\displaystyle {\begin{aligned}T_{\ce {A}}&=\sum _{0,nk}p\beta _{pq}[{\ce {A}}]^{p}[{\ce {B}}]^{q}\\[4pt]T_{\ce {B}}&=\sum _{0,nk}q\beta _{pq}[{\ce {A}}]^{p}[{\ce {B}}]^{q}\\\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c8d8b63491bb40690a8354ffecdfc2ec2e804777)

![{\displaystyle T_{{\ce {R}}}={\frac {{\ce {R}}_{0}+v_{i}{\ce {[R]}}}{v_{0}+v_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5014e528924b4e408f938a3b82cbfb58d71510c0)























![{\displaystyle {\begin{aligned}{\ce {L^3-}}+{\ce {H+ <=>}}\ {\ce {LH^2-}}&:\ [{\ce {LH^2-}}]=\beta _{11}[{\ce {L^3-}}][{\ce {H+}}]\\{\ce {L^3-}}+{\ce {2H+ <=>}}\ {\ce {LH2^-}}&:\ [{\ce {LH2^-}}]=\beta _{12}[{\ce {L^3-}}][{\ce {H+}}]^{2}\\{\ce {L^3-}}+{\ce {3H+ <=>}}\ {\ce {LH3}}&:\ [{\ce {LH3}}]=\beta _{13}[{\ce {L^3-}}][{\ce {H+}}]^{3}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9469a2a13baf9f2641763c2138eb0ec2a4f8f9cc)
![{\displaystyle {\ce {{LH2^{-}}+H+<=>LH3\ ;\quad \ [LH3]}}=K[{\ce {LH2^{-}}}][{\ce {H+}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/190cfd31265e8d89591f16358e006c3b2ecd4667)
![{\displaystyle \beta _{13}[{\ce {L^3-}}][{\ce {H+}}]^{3}=K\beta _{12}[{\ce {L^3-}}][{\ce {H+}}]^{2}[{\ce {H+}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4cd322811ee949833449526dd5951896bcd26b20)








