|
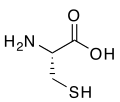
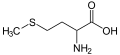
Compuesto de organoazufre Los compuestos organosulfurados o compuestos de organoazufre son compuestos orgánicos que contienen átomos de azufre enlazados a átomos de carbono. A menudo se asocian con malos olores, pero muchos de los compuestos más dulces conocidos son derivados organosulfurados. La naturaleza es rica en compuestos organosulfurados pues el azufre es esencial para la vida. Dos de los veinte aminoácidos comunes son compuestos organosulfurados. Los combustibles fósiles, carbón, petróleo y gas natural, que son derivados de materiales pertenecientes a organismos vivos antiguos, necesariamente contienen compuestos organosulfurados, la eliminación de los cuales es un objetivo importante de las refinerías de petróleo. El azufre pertenece al grupo 16 de la tabla periódica (anfígenos o calcógenos) junto con el oxígeno, y se espera que los compuestos organosulfurados tengan similitudes con los compuestos que contienen enlaces carbono-oxígeno, lo cual es cierto hasta cierto punto. Un análisis químico clásico para la detección de compuestos de azufre es el método de Carius. Clases de compuestos organosulfurados
Los compuestos organosulfurados se clasifican según el grupo funcional que contiene el átomo de azufre, como se indica en la tabla. Aparecen en orden decreciente de su ocurrencia.
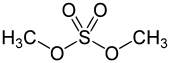
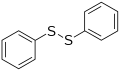
Tioéteres, tioésteres, tioacetalesEstos compuestos se caracterizan por contener enlaces C-S-C[15][16] En comparación con los enlaces C-C, los enlaces C-S son más largos, ya que el átomo de S es mayor que el de carbono, y un 10% más débiles. Las longitudes de enlace típicas en los compuestos de azufre son de 183 pm para el enlace S-C en el metanotiol y 173 pm, en el tiofeno. La energía de disociación de enlace C-S es de 89 kcal/mol (370 kJ/mol) para el tiometano en comparación con 100 kcal/mol (420 kJ/mol) para el metano y cuando el hidrógeno es reemplazado por un grupo metilo la energía se reduce en 73 kcal/mol (305 kJ/mol)[17] El enlace carbono-oxígeno simple posee menor longitud de enlace que el enlace C-C. Las energías de disociación de enlace del sulfuro de dimetilo y del dimetiléter son, respectivamente, 73 y 77 kcal/mol (305 y 322 kJ/mol. Los tioéteres se preparan habitualmente por alquilación de tioles. También se pueden preparar a través de un reordenamiento de Pummerer. En una reacción llamada reacción de Ferrario, el feniléter se convierte en fenoxatiína por acción del azufre elemental y del cloruro de aluminio.[18] Los tioacetales y los tiocetales muestran la característica secuencia de enlaces C-S-C-S-C. Representan una subclase de tioéteres. Los tioacetales son útiles en el umpolung (inversión de reactividad) de los grupos carbonilo. Los tioésteres tienen una estructura general R-CO-S-R. Están relacionados con los ésteres regulares, pero son más reactivos. Los tiofenos representan una clase especial de tioéteres que son aromáticos. La estabilización por resonancia del tiofeno es de 29 kcal/mol (121 kJ/mol) en comparación con los 20 kcal/mol (84 kJ/mol) para el análogo con átomos de oxígeno (furanos). La razón de esta diferencia es la mayor electronegatividad del oxígeno que desplaza electrones hacia sí mismo a expensas del anillo aromático. Sin embargo, como sustituyente aromático el grupo tio es menos efectivo como grupo de activación que el grupo alcoxi. Tioles, disulfuros, polisulfurosLos tioles contienen el grupo funcional R-SH. Los tioles son estructuralmente similares a los alcoholes, pero estas funciones son muy diferentes en sus propiedades químicas. Los tioles son más nucleofílicos, más ácidos, y se oxidan con mayor facilidad. Esta acidez puede variar en unas 5 unidades de pKa.[19] La diferencia en la electronegatividad entre el azufre (2,58) y el hidrógeno (2,20) es pequeña y por lo tanto, los enlaces de hidrógeno en los tioles no son significativos. Los tioles alifáticos forman monocapas de oro, que son de actual importancia en nanotecnología. Ciertos tioles aromáticos pueden ser obtenidos mediante una reacción de Herz. El Enlace disulfuro R-S-S-R con un enlace covalente azufre - azufre es importante para entrecruzamiento: en bioquímica para el plegado y la estabilidad de algunas proteínas, y en química de polímeros para la reticulación del caucho. También son conocidas cadenas más largas de átomos de azufre, como en el producto natural varacina, que contiene un inusual anillo de pentatiepina (cadena de 5 átomos de azufre ciclados sobre dos átomos de carbono contiguos de un anillo de benceno). Tiocetonas, tioaldehídos y compuestos relacionadosLos compuestos con doble enlace entre el carbono y el azufre (C=S) son relativamente poco comunes, pero son compuestos importantes el disulfuro de carbono, el sulfuro de carbonilo y el tiofosgeno. Las tiocetonas (RC(=S)R') son poco comunes con sustituyentes alquilo, pero un ejemplo es la tiobenzofenona. Los tioaldehídos son aún más raros, reflejando su falta de protección estérica (el tioformaldehído existe como un trímero cíclico). Las tioamidas, de fórmula R1C(=S)N(R2)R3 son más comunes. Por lo general son preparadas por reacción de amidas con reactivo de Lawesson. Compuestos que contienen dobles enlaces C = S existen en el iluro de sulfonio, por ejemplo, en la reacción de Johnson-Corey-Chaykovsky. Triple enlaces entre carbono y azufreLos triples enlaces entre el azufre y el carbono son raros en los sulfaalquinos y se pueden encontrar en el monosulfuro de carbono (CS)[20] y se han sugerido para los compuestos F3CCSF3[21][22] and F5SCSF3.[23] El compuesto HCSOH también se presenta como poseedor de un triple enlace formal.[24] Ácidos tiocarboxílicos y tioamidasLos ácidos tiocarboxílicos (RC(O)SH) y los ácidos ditiiocarboxílicos (RC(S)SH) son bien conocidos. Son estructuralmente similares a los ácidos carboxílicos, pero presentan más ácidez. Las tioamidas son análogas a las amidas. Ácidos sulfónicos, ésteres, amidasLos ácidos sulfónicos tienen el grupo funcional RS(=O)2OH.[25] Son ácidos fuertes que son típicamente solubles en disolventes orgánicos. Ácidos sulfónicos como el ácido trifluorometanosulfónico son reactivos de uso frecuente en química orgánica. Las sulfamidas son sulfonamidas derivadas mediante sulfonación aromática. Sulfuranos y persulfuranosLos sulfuranos son un grupo funcional relativamente especializado por ser tetravalentes, por tanto, son compuestos hipervalentes de azufre,[26] de fórmula SR4[27] y de igual forma, los persulfuranos son hexavalentes, de fórmula SR6. Los persulfuranos con todos los sustituyentes orgánicos han sido conocidos por ser los compuestos más pesados del grupo de los calcógenos, por ejemplo, el compuesto análogo hexametilpertelurano (Te(Me)6) fue descubierto en 1990[28] por reacción de tetrametiltelurio con difluoruro de xenón en Te(Me)2)F2 seguido de reacción con dietilzinc. El análogo de azufre, hexametilpersulfurano SMe6, se ha previsto que sea estable[29] pero no ha sido sintetizado aún. El primera persulfurano con todos los sustituyentes orgánicos que fue sintetizado en un laboratorio tiene dos ligandos metilo y dos bifenilo:[30]  Se prepara a partir del correspondiente sulfurano 1 con difluoruro de xenón/ trifluoruro de boro en acetonitrilo para dar el dicatión sulfuranilo 2 seguido de reacción con metillitio en tetrahidrofurano para dar un persulfurano (estable) 3 como isómero cis. La difracción de rayos X muestra que la longitud del enlace C - S oscila entre 189 y 193 pm (más largo que la longitud del enlace estándar) con el átomo central de azufre en una geometría molecular octaédrica distorsionada. Experimentos in silico sugieren que estos enlaces son muy polares con cargas negativas parciales sobre el carbono. Compuestos naturales organosulfuradosNo todos los compuestos organosulfurados son contaminantes malolientes. Compuestos como la alicina y el ajoeno son responsables del olor del ajo, y la lentionina contribuye al sabor de los hongos shiitake. Muchos de estos productos naturales también tienen importantes propiedades medicinales tales como prevención de la agregación de las plaquetas o en la lucha contra el cáncer. Compuestos organosulfurados en la contaminaciónLa mayoría de los compuestos orgánicos de azufre en el medio ambiente son de origen natural, como consecuencia del hecho de que el azufre es esencial para la vida y dos aminoácidos contienen este elemento. Algunos compuestos organosulfurados, presentes en el medio ambiente, se generan como subproductos de menor importancia de procesos industriales como la fabricación de plásticos y neumáticos. Determinados procesos producen compuestos organosulfurados como en la fabricación de coque de carbón, acción que se realiza para expulsar los compuestos de azufre y otras impurezas volátiles y así producir 'carbón limpio' (coque), que se utiliza principalmente para producción de acero. Compuestos organosulfurados en los combustibles fósilesTambién se producen sustancias malolientes en los procesos químicos de procesamiento del carbón o el crudo, en los que se obtienen precursores químicos (materias primas) para su posterior uso industrial (por ejemplo, para fabricar plásticos o en la producción farmacéutica), y por las necesidades en todas partes de la destilación del petróleo para obtener (gasolinas, diesel, y otros combustibles. Los compuestos organosulfurados podrían ser vistos como contaminantes malolientes que hay que eliminar del gas natural antes de su uso comercial, extraer de los gases de escape y de las chimeneas de las fábricas antes de su salida. En este último contexto, los compuestos organosulfurados forman parte de los contaminantes de azufre en la lluvia ácida, o igualmente, forma parte de los contaminantes en los combustibles fósiles más comunes, especialmente en el carbón. Véase también
Enlaces químicos del carbono con el resto de átomos
Enlaces externos
Referencias
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||