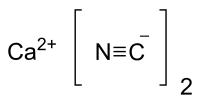|
Cianuro de calcio
El cianuro de calcio aparece como cristales o polvo blanco o polvo gris-negro (grado técnico).[2] Al igual que otros cianuros similares, es muy tóxico por absorción cutánea a través de heridas abiertas, por ingestión y por inhalación. Es un compuesto inorgánico con la fórmula Ca(CN)2. Es un sólido blanco, aunque rara vez se observa en forma pura. Las muestras comerciales suelen ser negro-grisáceas. Es la sal de calcio del cianuro de hidrógeno. Se hidroliza fácilmente (incluso en aire húmedo) para liberar cianuro de hidrógeno.[3] PreparaciónEl cianuro de calcio se puede preparar tratando el óxido de calcio (CaO) en polvo con ácido hidrociánico anhidro en ebullición en presencia de un acelerador como el amoníaco o el agua para minimizar la pérdida del ácido hidrociánico por polimerización: También se puede preparar haciendo reaccionar ácido hidrociánico líquido con carburo de calcio. Alternativamente, el cianuro de calcio se puede preparar haciendo reaccionar ácido cianhídrico gas con cal viva (CaO) a altas temperaturas alrededor de 400 °C. A temperaturas más altas alrededor de 600 °C se forma cianimida de calcio en su lugar.[4] El material preparado a menudo está contaminado con derivados poliméricos de cianuro de hidrógeno, de ahí el color negro. El cianuro de calcio se puede producir por azotación exotérmica de carburo de calcio a 1000 °C.[5] Surge como un intermediario en la producción de cianamida de calcio: El cianuro de calcio también se produce en disolución acuosa haciendo reaccionar el ácido hidrociánico con hidróxido de calcio:[6] ReactividadEl cianuro de calcio se hidroliza fácilmente para formar gas de cianuro de hidrógeno. La presencia de ácido acelera la evolución del cianuro de hidrógeno. Es reactivo a los agentes oxidantes. El cianuro de calcio también se usa a veces para producir cianuro de amonio haciéndolo reaccionar con carbonato de amonio. UsosEl cianuro de calcio se usa casi exclusivamente en la industria minera. Sirve como una fuente económica de cianuro en muchas operaciones de lixiviación o tina para obtener metales preciosos como el oro y la plata de sus minerales.[7] Lo hace formando complejos de coordinación con los metales que los separan de los minerales.[8] Se distribuye en forma de escamas sólidas o en forma líquida.[7] Referencias
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||