|
Agonista nicotínicoUn agonista nicotínico es cualquier sustancia que imite la acción de la acetilcolina (ACh) en los receptores de acetilcolina (nAChRs). El nAChR, acrónimo de nicotinic acetylcholine receptor en inglés, es nombrado así por su afinidad a la nicotina. Entre los agonistas nicotínicos se cuentan, además de la nicotina misma, la acetilcolina — agonista endógeno de los receptores nicotínicos de acetilcolina—, la colina, la epibatidina, la lobelina, la vareniclina y la cisteína. Debido al papel de los receptores nAChR en la trasmisión del señales en el sistema nervioso los agonistas nicotínicos tienen usos como drogas o fármacos. Historia La nicotina es bien conocida desde hace siglos por su efecto intoxicante. El químico alemán Posselt Reiman fue el primero en aislarla a partir de la planta del tabaco, en 1828.[1] A mediados de los 1980, se descubrieron los efectos positivos en la memoria de los animales. Esas investigaciones dieron paso a una nueva era de los estudios del receptor nicotínico de acetilcolina (nAChR) y su estimulación. Cabe mencionar que, hasta ese entonces, el foco de investigación había estado centrado únicamente en la adicción a la nicotina.[2][3] El desarrollo de los agonistas nAChR como agentes teurapéuticos empezó a inicios de los 1990. El ABT-418, designado así por Abbott Laboratories, fue uno de los primeros agonistas investigados. En experimentos con monos macacos maduros de diferentes especies y sexo se observó un incremento del tiempo en que permanece activa la memoria a corto plazo. El ABT-418 también se ha examinado con resultados positivos como un posible tratamiento para la enfermedad de Alzheimer, la enfermedad de Parkinson y el trastorno por déficit de atención con hiperactividad.[3] Uno de los primeros agonistas nicotínicos catalogados como drogas fue la galantamina, un alcaloide vegetal que actúa como un inhibidor leve de la colinesterasa, así como un sensibilizador alostérico para los nAChR.[4] Receptores nicotínicos de acetilcolina y su sistema de señalización Sistema de señalizaciónLas señales colinérgicas se transmiten todo el sistema nervioso mediante el neurotransmisor acetilcolina (ACh), sintetizado y secretado por las neuronas.[5][6] Los principales receptores de la acetilcolina son los receptores nicotínicos y muscarínicos. La estimulación colinérgica influye en diversas actividades fisiológicas, incluyendo el sueño, la ansiedad y el procesamiento del dolor y de las funciones cognitivas.[7] Receptores nicotínicos de acetilcolinaLos receptores nicotínicos de acetilcolina (nAChRs) son colinérgicos y se encuentran en el sistema nervioso central, en el sistema nervioso periférico y en los músculos esqueléticos. Estos receptores son ionotrópicos, es decir, están asociados a un canal iónico. Cuando la acetilcolina u otros agonistas nicotínicos se unen a los receptores, el canal iónico se abre y permite la afluencia de cationes como el potasio, el calcio y el sodio. Los nAChRs están compuestos por diferentes subunidades que determinan la estructura cuaternaria del receptor, conocidas como las subunidades α (α1-α10), subunidades β (β1-β4), y subunidades γ, δ y ε. Los nAChRs pueden ser heteroméricos u homoméricos. Los receptores heteroméricos se hallan en el sistema nervioso central y están compuestos por dos subunidades α y tres subunidades β. Estos receptores contienen dos sitios de enlace y tienen diferentes afinidades por sustancias químicas, dependiendo de la composición de las subunidades. Los sitios de enlace trabajan conjuntamente y deben estar ambos ocupados con un agonista nicotínico para que pueda tener lugar la activación del canal.[8] Los nAChRs compuestos por las subunidades α2-α6 y β2-β4 tienen mayor afinidad por la acetilcolina. Los receptores homoméricos están formados por cinco subunidades idénticas y tienen cinco sitios de enlace situados en las interfaces entre cada par de subunidades adyacentes. A fecha del año 2000, se habían identificado dos receptores homoméricos en los seres humanos, los receptores α7 y α8.[7][9][10][11] Mecanismo de acción Los agonistas nicotínicos se unen a los receptores de acetilcolina debido a la atracción generada por la diferencia de carga entre ellos y la superficie de los receptores en el sitio de enlace, una oquedad existente entre una subunidad α y la subunidad adyacente del receptor. Una vez que la acetilcolina o agonista se ha alojado en el sitio de enlace se producen movimientos en la subunidad α del receptor en que fortalecen los enlaces químicos entre la molécula y el receptor.[12] La configuración del receptor y el tipo de subunidades que lo componen influyen en la afinidad del receptor por diferentes tipos de agonistas y antagonistas y en su función biológica. Receptor α4β2Los receptores a4β2 constan de dos subunidades α4 y tres subunidades ß2, con dos sitios de enlace para la acetilcolina y otros agonistas. Representan aproximadamente el 90 % de los receptores nicotínicos en el cerebro humano. La exposición crónica a la nicotina u otros agonistas lleva a un aumento en la densidad de receptores α4β2, a diferencia de lo que suele ocurrir con otros receptores. El receptor α4β2 ha sido ampliamente estudiado en el contexto de la enfermedad de Alzheimer, e investigaciones sobre la dependencia de la nicotina; desde 2009, existen varios fármacos en el mercado que actúan sobre este receptor.[13][14] Receptor α7Los receptores homoméricos α7 están compuestos de cinco subunidades α7 y tienen cinco sitios de enlace. Las anomalías en la expresión de los receptores α7 pueden influir en la progresión de dolencias como la enfermedad de Alzheimer y la esquizofrenia. Se piensa que el α7 no tiene tanta afinidad por la nicotina como los receptores heteromérico, pero se enlaza con mayor preferencia a la alfa-Bungarotoxina, un antagonista nicotínico presente en el veneno de algunas serpientes. Los receptores α7 son considerados un blanco útil para fármacos para el tratamiento de la enfermedad de Alzheimer y la esquizofrenia.[8][15] Receptor muscularSe han descubierto dos receptores nicotínicos en la unión neuromuscular en los músculos esqueléticos. Uno de ellos se encuentra principalmente en individuos adultos y contiene dos subunidades α1 y β1, una subunidad ε y una subunidad δ. El otro tipo de receptor neuromuscular se ha encontrado en los fetos y presenta una subunidad γ en lugar de la subunidad ε. Estos nAChRs toman parte en la despolarización de la terminal muscular mediante el aumento de la permeabilidad a los cationes que causan la contracción muscular.[16] Tienen dos sitios de enlace, uno en la interfaz entre las subunidades α1 y δ y otro entre las subunidades α1 y γ o ε. El gas nervioso y algunos insecticidas actúan como antagonistas de los receptores nicotínicos neuromusculares.[11] FarmacologíaLos fármacos que actúan sobre los receptores de acetilcolina pueden ser agonistas, agonistas parciales o antagonistas. Los agonistas pueden actuar como agentes despolarizantes, disminuyendo el potencial de membrana en las neuronas durante un tiempo de segundos o minutos, dependiendo de la concentración y el tipo de receptor. La exposición crónica al agonista puede conducir a una desactivación funcional duradera debido a una desensibilización rápida y persistente. Los agonistas parciales parecen estimular la liberación de dopamina en porciones más pequeñas que los agonistas como la nicotina, razón por la que se los ha estudiado como ayuda para dejar de fumar.[17] La falta de especificidad de algunos de los agonistas nicotínicos es bien conocida, y supone un problema potencial cuando se utilizan para tratar enfermedades que requieren tratamiento centrado en un subtipo específico de nAChR. Entre estos agonistas no específicos se encuentran, por ejemplo, la aceticolina, la nicotina y la epibatidina, todos capaces de unirse a más de un subtipo de receptor.[18] Farmacóforo El estudio del farmacóforo agonista nicotínico comenzó en 1970, cuando se propuso que la unión de los agonistas a los receptores se efectuaba mediante un enlace entre un átomo de nitrógeno cargado positivamente y un oxígeno carbonilo en la acetilcolina o un nitrógeno en la (S)-nicotina. Desde entonces, se ha demostrado que la presencia de un centro catiónico con un átomo electronegativo y un aceptor de un enlace de hidrógeno son características determinantes.[19] La estereoquímica también es un factor de importancia en el farmacóforo, como se comprueba en el caso de la (S)-nicotina, entre 10 y 100 veces más potente que su isómero (R)-nicotina. El anillo azabicíclico de la epibatidina es otro ejemplo de una interacción estereoquímica favorable. Se ha sugerido que la distancia internitrogénica N+-N está relacionada con la afinidad agonista pero es un factor sujeto a debate. Una densidad electrónica baja en la proximidad del nitrógeno cargado positivamente y una densidad más alta cerca del anillo de piridina —en los compuestos que lo contengan— se considera un factor favorable.[20] Relación estructura-actividadAgonistas de los nAChR muscularesSe han examinado diversos modelos para determinar las moléculas, grupos funcionales y conformaciones estereoquímicas con mayor afinidad hacia los nAChR. Usando un receptor muscular del subtipo (α1)2β1δγ se obtuvieron los siguientes resultados:
Es decir, la anatoxina presentó la mayor actividad y la tubocurarina, la más baja; la acetilcolina indujo una mayor duración de la apertura del receptor, a pesar de no ser tan potente como la anatoxina. Los resultados sugieren que los derivados de la anatoxina serían útiles para comprender la relación entre la estructura y la actividad para los receptores musculares.[21] Los ésteres biscolina, entre los que se encuentra la succinilcolina, un relajante muscular de acción corta usado en anestesiología, son una clase de compuestos que pueden actuar como un agonista competitivo en nAChRs musculares, por lo que se usan para estudiar la influencia de la estructura en la función. Con un modelo de receptor (α1)2β1δγ de la raya torpedo, se comprobó que la potencia como agonistas de los ésteres biscolina aumenta con la longitud de la cadena. La eficacia, por otro lado, parece ser independiente de la longitud.[22] Agonistas de los nAChR α4β2 La combinación de elementos estructurales de la acetilcolina y la nicotina, así como la reducción de la flexibilidad conformacional mediante el uso de un anillo de ciclopropano, ha llevado al descubrimiento de ligandos potentes y selectivos de nAChR del tipo α4β2. La potencia y selectividad están determinadas por la modulación de tres elementos estructurales, el enlazador, la sustitución en el grupo amino y el anillo de piridina. Los factores que dificultan la unión son el impedimento estérico en el grupo amino y los enlazadores con largas cadenas insaturadas o saturadas. Los enlazadores formados por grupos éter de cadena corta son más propensos a la unión, así como una o dos sustituciones en el anillo de piridina con halógenos u otros grupos. También se ha observado un aumento de la afinidad de unión con la sustitución en el grupo amino de tres diferentes amidas; la metilamida exhibe el más alto grado de unión, lo que se explica por una orientación estérica más favorable o la interacción hidrofóbica con el grupo metilo. La estereoquímica del nitrógeno y el anillo de la piridina y sus efectos estereoelectrónicos tienen un sutil efecto beneficioso en la unión a los receptores α4β2. El ligando de potencia más alta hallado es un éter de piridilo, con sustituciones de bromo en la piridina y amida metilada en el grupo amino.[23] Agonistas de los nAChR α7  La búsqueda de agonistas potentes de los receptores de tipo α7 ha resultado en una serie de compuestos con un alto potencial como fármacos. Como ejemplo se puede citar SEN12333/WAY-317538, un compuesto con un perfil farmacocinético deseable y más afín a los nAChR α7 que a los α1, α3 y α4β2.[15] El farmacóforo óptimo del agonista de los nAChR α7 está compuesto de tres partes. Hay una porción básica conectada a una cadena de carbono unida a una porción aromática por un puente de amida. El puente de amida se puede invertir sin afectar la potencia del agonista. Las porciones aromáticas con un grupo biarilo muestran más potencia que las que constan de un grupo monoarilo, y una sustitución en la posición 2 del grupo arilo aumenta aún más la potencia. La potencia es mayor para los agonistas con donor o aceptor de H+ en el último arilo del grupo biarilo. Un alto número de aceptores de enlace de hidrógeno podría disminuir la permeabilidad a través de la barrera hematoencefálica, debido a la superficie polar de los agonistas específicos de los nAChR α7.[15] Existen varios grupos amino cíclicos que pueden actuar como la porción básica sin grandes diferencias en la potencia; entre ellos se cuentan la piperazina, la piperidina y el morfolina. También puede desempeñar este rol una amina terciaria acíclica, pero los grupos de mayor volumen conducen a una pérdida de efectividad.[15] Muchos derivados de quinuclidina, como la amida de quinuclidina, son agonistas de los receptores α7. Entre los factores que favorecen la potencia y la afinidad de estos agonistas se pueden mencionar una sustitución «para» en el anillo de quinuclidina y una la configuración estereoquímica 3-(R). Asimismo, se da una mayor actividad cuando un anillo de 5 miembros se fusiona a un residuo aromático, especialmente cuando el anillo fusionado es capaz de suministrar electrones deslocalizados al carbonilo de la amida. La actividad disminuye cuando el anillo condensado contiene un átomo con la capacidad de formar un enlace de hidrógeno. Se presume que la rigidez de la quinuclidina y la orientación ortogonal del puente de nitrógeno en relación con el grupo carbonilo de la amida son importantes para la unión óptima con el receptor. Aunque algunos de los derivados de la amida de quinuclidina más potentes son poco estables in vitro, la adición de un grupo metilo en la posición 2 del anillo de quinuclidina aumenta la estabilidad considerablemente.[24]
Uso en la medicinaEl interés por los agonistas de receptores nicotínicos de acetilcolina comenzó a principios de la década de 1990 tras el descubrimiento de los efectos positivos de la nicotina en la memoria animal,[2][3] y ha aumentado desde entonces por su potencial como fármacos para tratar varios trastornos del sistema nervioso central, tales como la enfermedad de Alzheimer, la esquizofrenia, el trastorno por déficit de atención con hiperactividad (TDAH) y la adicción a la nicotina.[25][26] La tabla siguiente lista medicamentos en el mercado que actúan en los nAChRs.
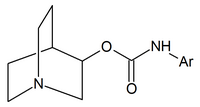
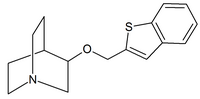
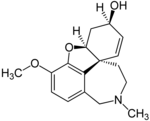
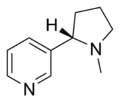
Otros agonistas nicotínicos de uso clínico limitado incluyen:
Drogas en etapa de estudioUn medicamento experimental conocido como AZD0328, fue estudiado entre 2009-2014 como agonista alfa7. Referencias
Enlaces externos
|