|
Adalimumab
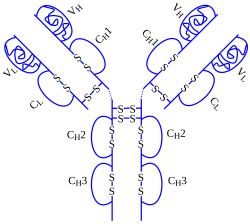
El adalimumab es un anticuerpo monoclonal incluido entre el grupo de fármacos conocido como tratamiento biológico. Su mecanismo de acción es doble: por una parte, disminuye el efecto del factor de necrosis tumoral (TNF-α), que es una citocina que producen diversas células de nuestro cuerpo y que aumenta los síntomas inflamatorios. Por otra, induce la apoptosis (muerte celular) de linfocitos que se encuentran anormalmente activados. Entre las aplicaciones de adalimumab se emplea para el tratamiento de la artritis reumatoide, enfermedad de Crohn, la artritis psoriásica , la psoriasis y la hidradenitis supurativa. La administración de adalimumab se realiza en general mediante inyección subcutánea, y puede hacerse en el domicilio del paciente, con una periodicidad variable. En general se administra cada 2 semanas. Adalimumab es comercializado por los laboratorios AbbVie [1]. El uso presenta ciertos riesgos y efectos secundarios que en ocasiones pueden resultar mortales. Entre los riesgos más graves se encuentra un aumento en el riesgo de padecer cánceres de piel como melanomas. Al reducir el efecto del sistema inmune, fármacos basados en Adalimumab como Humira incrementan el riesgo de sufrir infecciones. Los riesgos de Adalimumab a corto y medio plazo están ya establecidos. El medicamento lleva en comercialización desde 2003, por lo que aún no se conocen con claridad otros posibles riesgos adicionales derivados de su uso a largo plazo. El adalimumab está en la lista de los medicamentos esenciales de la OMS.[1] Véase tambiénReferencias
Enlaces externos
|
|||||||||||||||||||||||||||||||||||||||||||||