|
Abiogénesis  La abiogénesis (del griego antiguo: ἀ-βίο-γένεσις [a-bio-génesis] ‘ἀ-/ἀν- «no» + βίος- «vida» + γένεσις- «origen/principio»’) es una hipótesis que sugiere que la vida se originó a partir de materia inorgánica, por medio de un proceso gradual y secuencial de formación de moléculas orgánicas, seguido de su acumulación y formación de redes químicas complejas, que al final formaron las primeras células.[3][4] La abiogénesis es una de las teorías que intenta explicar el origen y evolución de la vida en la Tierra, y en el universo. El estudio del origen de la vida es multidisciplinario. Con el objetivo de reconstruir el evento o los eventos que derivaron en el surgimiento de los primeros seres vivos, se emplean diversos enfoques basados en estudios tanto de campo como de laboratorio. Con el objetivo de reconstruir el evento o los eventos que dieron origen a la vida se emplean diversos enfoques basados en estudios tanto de campo como de laboratorio. Por una parte el ensayo químico en el laboratorio o la observación de procesos geoquímicos o astroquímicos que produzcan los constituyentes de la vida en las condiciones en las que se piensa que pudieron suceder en su entorno natural. En la tarea de determinar estas condiciones se toman datos de la geología de la edad oscura de la tierra a partir de análisis radiométricos de rocas antiguas, meteoritos, asteroides y materiales considerados prístinos, así como la observación astronómica de procesos de formación estelar. Por otra parte, se intentan hallar las huellas presentes en los actuales seres vivos de aquellos procesos mediante la genómica comparativa y la búsqueda del genoma mínimo. Y, por último, se trata de verificar las huellas de la presencia de la vida en las rocas, como microfósiles, desviaciones en la proporción de isótopos de origen biogénico y el análisis de entornos, muchas veces extremófilos semejantes a los paleoecosistemas iniciales. Existe una serie de observaciones que intentan describir las condiciones fisicoquímicas en las cuales pudo emerger la vida, pero todavía no se tiene un cuadro razonablemente completo dentro del estudio de la evolución de la complejidad biológica, acerca de cómo pudo ser este origen. Se han propuesto varias teorías, siendo la hipótesis del mundo de ARN y la teoría del mundo de hierro-azufre[5] las más aceptadas por la comunidad científica. HistoriaEl concepto de un origen de la vida basado en principios naturales y no en relatos míticos o actos creativos ya aparece esbozado en varias culturas antiguas. Así, los filósofos presocráticos afirmaron que todos los seres, incluidos los vivos, surgían del arjé. Anaximandro (aprox. 610-546 a. C.) afirmaba que la vida se había desarrollado originalmente en el mar y que posteriormente esta se trasladó a la tierra, en tanto Empédocles (aprox. 490-430 a. C.) escribió sobre un origen no sobrenatural de los seres vivos.[6] Posteriormente Lucrecio, siguiendo la doctrina epicúrea afirma en De rerum natura, que todos los organismos surgen de Gea sin necesidad de intervención divina, y que solo los organismos más aptos han sobrevivido para tener descendencia. Aunque esta afirmación pudiera parecer una anticipación de la teoría de la selección natural, a diferencia de esta los epicúreos no admiten un origen común para todas las especies, sino más bien generaciones espontáneas para cada una de ellas. Estas ideas influyeron a varios filósofos a partir del renacimiento.[7] La cuestión de la generación espontánea: de Aristóteles a Pasteur En el momento en que Darwin defiende el transformismo y la ascendencia común de todos los organismos vivos, asume que, en última instancia, el primer organismo original debió surgir a partir de la materia inorgánica. Esto queda claro cuando en su segundo cuaderno, escrito en 1837, afirma:
Sin embargo, cuando los evolucionistas de los siglos XVIII y XIX, entre ellos Darwin, se muestran partidarios de la generación espontánea, el concepto había variado sustancialmente de lo expuesto por Aristóteles. Mientras que este invocaba una causa extraña a la naturaleza, los avances científicos en el campo de la química hacían pensar a los evolucionistas, como vemos en la cita de Darwin, que la vida surgía de las propiedades de la materia. Según el filósofo estagirita, por ejemplo, era una verdad patente que los pulgones surgían del rocío que cae de las plantas, las pulgas de la materia en putrefacción, los ratones del heno sucio o los cocodrilos de los troncos en descomposición en el fondo de las masas acuáticas. Todos ellos se originaban a partir de una fuerza vital a la que nombró entelequia. Esta fuerza insuflaba el "pneuma" o alma a la materia inerte, animándola.[8] La autoridad que se le reconoció a Aristóteles hizo que esta opinión prevaleciera durante siglos y fuera admitida por pensadores tan ilustres como Descartes, Bacon o Newton. También importantes naturalistas defendieron esta doctrina, como Alexander Ross o Jan Baptista van Helmont. Sin embargo, comienzan a aparecer fuertes oposiciones a esta teoría entre otros naturalistas, como Sir Thomas Browne o Lazzaro Spallanzani, siguiendo la doctrina de William Harvey sumarizada en el aforismo omne vivum ex ovum. En 1668, el italiano Francesco Redi realizó un experimento en el que comprobó que no aparecía ninguna larva en la carne en descomposición cuando se impedía que las moscas depositaran en ella sus huevos. Tras este experimento pareció claro que el fenómeno de la generación espontánea no se podía aplicar a organismos pluricelulares. Pero este experimento, debido al tamaño de poro de la gasa que empleó para impedir que penetraran los huevos de las moscas, no invalidaba la posibilidad de la generación espontánea para los microorganismos. La existencia de estos seres había sido intuida en 1546 por el médico Girolamo Fracastoro, argumentando en contra de la generación espontánea, y estableciendo la teoría de que las enfermedades epidémicas estaban provocadas por pequeñas partículas diminutas e invisibles o "esporas", que podrían no ser criaturas vivas, pero no fue aceptada ampliamente. Más tarde Robert Hooke publicó los primeros dibujos sobre microorganismos en 1665. Por otra parte, en 1676, Anton van Leeuwenhoek descubrió los microorganismos que, según sus dibujos y descripciones, podrían tratarse de protozoos y bacterias. Esto encendió el interés por el mundo microscópico.[9] Tras ello, el sacerdote católico inglés John Needham defendió el supuesto de la abiogénesis para los microorganismos en su obra Observations upon the generation, composition and decomposition of animal and vegetable substances (Londres, 1749) realizando un experimento en el que calentó un caldo mixto de pollo y maíz en un frasco de boca ancha y en el que aún aparecieron microorganismos a pesar de haber sido tapado con un corcho. Contra esto, en 1768 Lazzaro Spallanzani probó que los microorganismos estaban presentes en el aire y se podían eliminar mediante el hervido. Darwin, pensando en estos antecedentes, y dado que los evolucionistas defendían el materialismo, y en última instancia esto suponía que de la propia naturaleza de la materia debía surgir la vida, fue excesivamente cauteloso a la hora de proponer un paso entre la materia inorgánica y la vida, hasta tal punto que su amigo Ernst Haeckel llegó a decir:
Finalmente, doce años tras la publicación de El origen de las especies, Darwin escribe una célebre carta el 1 de febrero de 1871 a su amigo Joseph Dalton Hooker en la que declara:[10]
El mismo año de la publicación de El origen de las especies (1859), Louis Pasteur comienza a realizar los célebres experimentos que prueban la imposibilidad de la generación espontánea para cualquier organismo viviente, incluyendo los microorganismos. Desde tiempos de Lamarck la generación espontánea estaba asociada en Francia no solo con el pensamiento evolucionista, sino con el radicalismo político y el laicismo. La Iglesia católica y el conservadurismo político se posicionaban en contra de la teoría de generación espontánea. Consciente de las implicaciones de sus experimentos, Pasteur afirma en una disertación en 1864 en la Universidad de la Sorbona:
Los experimentos de Pasteur causaron tal impacto, que durante un tiempo el debate se desplazó de la comunidad científica. El propio Huxley, amigo y firme partidario de Darwin, rechazó la posibilidad de que la materia orgánica surgiera de la inerte en una conferencia impartida en 1870 titulada "Biogénesis y abiogénesis", en la que acuñó este último término haciéndolo sinónimo de generación espontánea. Comienza a popularizarse por ello la idea de la eternidad de la vida, sostenida entre otros por el químico William Thierry Preyer. Más tarde Oparin diría que ésta sería la última formulación de la doctrina conocida como vitalismo, que sostiene que la materia viva posee una cualidad esencial llamada "fuerza vital" que la distingue de la materia inanimada. Para salvar la cuestión, algunos científicos comienzan a apoyar la teoría de la panspermia, publicada por Richter en 1865, en la que se propone que la vida pudo haber llegado a la tierra desde el espacio. Hermann von Helmholtz afirma que los microbios primitivos o cosmozoa llegaron a la Tierra en meteoritos. Curiosamente, este punto de vista también fue adoptado por opositores de la evolución, como Lord Kelvin. Aún encontramos en estos años científicos que afirman haber presenciado hechos de generación espontánea, como el parasitólogo Henry Charlton Bastian, quien sin embargo afirma que detrás de estos fenómenos no había ninguna comunicación de "fuerza vital", sino solo la arquebiosis, otro término similar a la abiogénesis. El propio Darwin en una carta a Alfred Russel Wallace duda de la validez de los experimentos de Bastian, aun cuando se muestra partidario de la arquebiosis. De Pasteur a Oparin y HaldaneEn 1828 Friedrich Wöhler realiza la síntesis de la urea, la primera sustancia química presente en los seres vivos en ser sintetizada en el laboratorio. Esto refutaba la afirmación que Berzelius había hecho el año anterior, quien escribió:
Aunque Wöhler fue aclamado como un paladín contra la doctrina del vitalismo, lo cierto es que nunca presentó su descubrimiento de esta manera y tampoco se preocupó del alcance de sus implicaciones en el terreno de la biología fundamental. Desde que Purkinje y Hugo von Mohl afirman que el protoplasma es el componente fisicoquímico básico de la vida, y Thomas Graham la caracteriza como un coloide de proteínas, se entiende, como escribe Huxley que los rasgos de la vida se deben entender desde las propiedades físicas y químicas de las moléculas que lo componen. A lo largo de todo el siglo XIX se va a completar la síntesis de todos los componentes orgánicos de la célula con químicos como Adolph Strecker (alanina), Aleksandr Bútlerov (azúcares) y Dmitri Mendeléyev (ácidos grasos). A finales de este siglo, la síntesis de biomoléculas había avanzado bastante utilizando gases y descargas eléctricas. Sin embargo, ninguno de estos químicos, al igual que Wöhler, se preocupó en exceso de las implicaciones de sus trabajos en la cuestión del origen de la vida. Mientras tanto, del lado de los teóricos de la biología fundamental va ganando aceptación la idea de que la vida surgió de una transformación gradual de la materia inorgánica, si bien las teorías que se presentan no son muy aceptadas debido a que eran bastante incompletas y especulativas. Todas ellas tienen en común que consideran que el primer organismo debió ser autótrofo. Al descubrirse el fenómeno de la catálisis química de las enzimas, empieza a aparecer la hipótesis de que alguna de estas moléculas podría estar viva y representaría estados primordiales de la evolución. En 1917 Felix D'Herelle descubre una sustancia filtrable que atacaba a los bacilos y que posteriormente se identificó como bacteriófagos, y la propone como una de estas entidades primordiales. Entre 1914 y 1917 Leonard Troland propone que el primer organismo vivo debió de ser una enzima autorreplicante, lo que constituye el primer precedente teórico del mundo de ARN. Incluso la llega a denominar como "enzima genética". No mucho después, Hermann Joseph Muller, un colaborador del redescubridor de las leyes de Mendel, Morgan, corrige a Troland y afirma que esta enzima autorreplicante debió ser un gen o conjunto de genes, y que debían de ser autótrofos. Sin embargo, dada la complejidad de los mecanismos de nutrición autótrofa actuales, varios autores, como Charles Lipman y Rodney Beecher Harvey, ambos en 1924, comienzan a proponer un origen heterótrofo de la vida. Harvey incluso propone un origen de la vida en fuentes hidrotermales, siendo ésta la primera propuesta de este tipo. El mismo año, Aleksandr Oparin publica su obra El origen de la vida en la Tierra,[11][12] Asumiendo que el primer ser vivo debió ser heterótrofo, se hacía necesario que estuvieran presentes en la tierra los nutrientes necesarios, procedentes o bien del espacio o bien de algún tipo de síntesis inorgánica natural. Sin embargo, en ningún momento asumió ningún tipo de atmósfera anóxica primitiva.  También ese mismo año J.B.S. Haldane sugirió que los océanos prebióticos de la Tierra, muy diferentes a los actuales, habrían formado una «sopa caliente diluida» en la cual se podrían haber formado los compuestos orgánicos constituyentes elementales de la vida gracias a la ausencia de oxígeno, influido por los experimentos de Edward Charles Cyril Baly, que había sintetizado azúcares mediante una disolución acuosa de dióxido de carbono y radiación ultravioleta. Esta idea se llamó biopoesis, es decir, el proceso por el cual la materia viva surge de moléculas autorreplicantes pero no vivas.[13] Familiarizado con los trabajos de D'Herelle, propone que los virus fueron el paso intermedio entre la sopa prebiótica y la vida. Posteriormente, en la edición en ruso de 1936 de El origen de la vida, Oparin también adoptaría el punto de vista de una atmósfera original altamente reductora, en parte debido al conocimiento de la composición atmosférica de Júpiter, y en parte por las observaciones de Vladímir Vernadski de que el oxígeno procedía de la actividad biológica. Oparin era un evolucionista convencido, y por ello estableció una secuencia de acontecimientos por la que estas primeras sustancias orgánicas se transformaban gradualmente mediante selección natural hasta formar un organismo vivo. Uno de los escollos era la necesidad de concentrar dentro de una localización varios sustratos que actuaban conjuntamente formando un metabolismo, evitando la dilución. Oparin fue un firme partidario, y tal vez el primer postulante de la idea de "metabolismo primero" en el origen de la vida. Y por ello propuso que los coacervados eran las estructuras químicas más idóneas para ello. Sin embargo, posteriormente, dadas las evidencias experimentales que se acumularon rechazando esta posibilidad, se arrepentiría de esta idea afirmando que si pudiera volver atrás, investigaría en los liposomas. Inicio de la química prebiótica  La Segunda Guerra Mundial marcó un intervalo en la comprobación experimental de las hipótesis de Haldane y Oparin. Sin embargo, solo tres años después de la victoria aliada, se realizan los primeros experimentos a cargo de Melvin Calvin, descubridor del ciclo de Calvin, intentando simular las condiciones existentes en la tierra primigenia utilizando una fuente de radiación de alta energía, obteniendo un éxito muy discreto. En estas fechas, Harold Urey se trasladó a la Universidad de Chicago, y ya estaba convencido de que la atmósfera primitiva era altamente reductora, y finalmente impartió un seminario en 1951 en el que propuso que la condición reductora primitiva del sistema solar fue importante para el origen de la vida. Ese mismo año llegó a la universidad Stanley Miller, quien cuando aún era estudiante de licenciatura, inmediatamente propuso que sería interesante simular esas condiciones de la tierra primitiva para comprobar si era posible la síntesis de compuestos orgánicos. Ambos estaban familiarizados con las teorías de Oparin, pero al mismo tiempo estaban sorprendidos de que nadie hubiera realizado experimentos con éxito basados en sus ideas. Los experimentos, que comenzaron en 1953, fueron llevados a cabo bajo condiciones que recordaban aquellas que se pensaba que habían existido en el sistema océano-atmósfera después de que la Tierra completara su acreción a partir de la nebulosa solar primordial. El experimento usaba una mezcla altamente reductora de gases (metano, amoníaco e hidrógeno) y agua, a la que se le aplicaban descargas eléctricas para simular las fuentes de energía presentes en la atmósfera a partir de rayos y descargas coronales. Las reacciones tenían lugar en un aparato con varios depósitos esterilizados de vidrio comunicados mediante conductos. Uno de ellos, de forma esférica (balón), estaba lleno hasta la mitad con agua a la que se le aplicaba calor para producir evaporación. El vapor, era conducido a otra cámara de vidrio esférica con la mezcla de gases a una presión máxima de 1,5 bares. En esa cámara, un par de electrodos de tungsteno generaban arcos voltaicos de corta duración y elevada frecuencia con un voltaje de 60.000 voltios. Los productos de esta cámara se condensaban y reintroducían en el balón de evaporación. Tras dos semanas de operación, entre 10 y 15 % del carbono había formado compuestos orgánicos, 2% de ellos aminoácidos en forma de mezcla racémica, siendo el más abundante la glicina. También registraron la presencia de azúcares. Stanley Miller continuó toda su vida con estos experimentos, consiguiendo generar algunos compuestos orgánicos en los más variados supuestos de la composición de la atmósfera primitiva, incluidos los que actualmente se piensa que existieron. En 2007, una revisión de los materiales originales del experimento sellados y preservados, comprobó la presencia de más de 20 aminoácidos distintos que Urey y Miller no pudieron detectar. La síntesis prebiótica y la estructura del ADN La publicación de Stanley Miller en 1953 apareció tan solo tres semanas después de que Francis Crick y James Dewey Watson dieran a conocer la estructura del ADN. Este descubrimiento marcaría completamente los posteriores trabajos y teorías sobre el origen de la vida. Una excepción fue Sidney Fox, quien no abordó en sus experimentos los ácidos nucleicos. Uno de los problemas que achacaban a los experimentos de Miller era que aunque se obtenían biomoléculas sencillas, no se encontraban los biopolímeros que están presentes en todos los organismos vivos. Fox dirigió una serie de experimentos a finales de los años 1950 y principios de los 60 imitando las condiciones que existían en las proximidades de los volcanes y fuentes hidrotermales. Mediante un proceso que denominó "copolimerización térmica de aminoácidos" obtuvo distintos polipéptidos que recordaban a las proteínas, los proteinoides, que bajo determinadas circunstancias se agregaban formando microesferas, que exhibían ciertos comportamientos semejantes a las células, y por ello propuso que este tipo de estructuras podrían ser las antecesoras de la organización celular. Por el contrario, Joan Oró intentó hacer confluir los avances en la química prebiótica con la creciente importancia de los estudios sobre el ADN, en especial, de la polinucleótido fosforilasa, enzima capaz de polimerizar ácido ribonucleico sin ningún molde, que su compatriota Severo Ochoa acababa de aislar en 1955. En la Navidad de 1959 consiguió sintetizar adenina en condiciones que se suponía que existían en la tierra primitiva. Se obtuvieron cantidades significativas de esta sustancia calentando una disolución de cianuro de hidrógeno y amoniaco en agua durante varios días a temperatura moderada (27 °C - 100 °C). Según aparece en su publicación original, se considera que estos materiales son abundantes en el sistema solar. Pronto estos estudios generaron un gran debate en el contexto de la guerra fría. Hermann Joseph Muller reactualizó su teoría original sobre la naturaleza primordial de los genes en la vida. En 1961 publica un artículo titulado "Ácido nucleico genético: el material clave en el origen de la vida" en el que afirma:
Para Muller, la esencia de la vida es una sustancia capaz de catalizar reacciones y al mismo tiempo ser capaz de autorreplicarse. Esta es la formulación dura de las posteriores teorías clasificadas como de "genes primero". El mismo año, y al respecto de la polinucleótido fosforilasa, Oparin contestaría a Muller admitiendo un papel esencial de los ácidos nucleicos en el origen de la vida, pero afirmando que la síntesis de proteínas era el resultado de una "evolución prebiótica" entre los polipéptidos primordiales y los ácidos nucleicos, tachando de reduccionista la propuesta de Muller y enmarcando esta evolución dentro de un "flujo metabólico". Este tipo de propuestas serían clasificadas posteriormente como teorías de "metabolismo primero". Condiciones inicialesEl conocimiento de las condiciones iniciales es de extrema importancia para el estudio del origen de la vida. Para ello se emplea la teoría geoquímica en el estudio de las rocas antiguas y se efectúan simulaciones de laboratorio por medio de ordenadores (experimentos que se denominan in silico). Uno de los puntos centrales es determinar la disponibilidad de elementos y moléculas esenciales, en especial metales, puesto que son indispensables como cofactores en la bioquímica, así como su estado redox en las distintas localizaciones.[14] Asimismo, es esencial datar las primeras manifestaciones de la vida para aproximar el lapso de tiempo en el que estamos buscando. Según las evidencias, aunque están sujetas a controversia, la vida debió aparecer tras el enfriamiento del planeta que siguió al bombardeo intenso tardío, hace unos 4000 millones de años. Aunque todos los seres vivos parecen provenir de un único organismo ancestral, en este apartado cabe preguntarse si hubo varias apariciones «fortuitas» de formas de vida tras las que solo sobrevivió una, o si bien esas formas de vida aún sobreviven tal vez en ambientes extremos como en las profundidades de la corteza continental o en el manto.[14] Evidencias de la antigüedad de la vidaUna de las formas de verificar la actividad biológica es una curiosa propiedad de los sistemas celulares: la capacidad de favorecer ciertos isótopos de un mismo elemento en sus procesos. Esto ocurre, por ejemplo, en la fotosíntesis en la que se incorpora CO2 de diversas fuentes para transformarlo en moléculas orgánicas. Existen dos isótopos estables del carbono, C12 y C13, siendo estables sus abundancias relativas en la atmósfera. Cuando un sistema biológico incorpora CO2 prefiere el isótopo más ligero, enriqueciendo las rocas carbonatadas por el otro isótopo.[15] La prueba de una aparición temprana de la vida viene del cinturón supracortical de Isua en Groenlandia occidental y formaciones similares en las cercanas islas de Akilia. El carbono que forma parte de las formaciones rocosas tiene una concentración de δ13C elemental de aproximadamente −5,5, lo que debido a que en ambiente biótico se suele preferir el isótopo más ligero del carbono,12C, la biomasa tiene una δ13C de entre −20 y −30. Estas «firmas» isotópicas se preservan en los sedimentos, Mojzis[16] ha usado esta técnica para sugerir que la vida ya existió en el planeta hace 3850 millones de años. Lazcano y Miller (1994) sugieren que la rapidez de la evolución de la vida está determinada por la tasa de agua recirculante a través de las fumarolas submarinas centrooceánicas. La recirculación completa lleva 10 millones de años, por ello cualquier compuesto orgánico producido por entonces podría ser alterado o destruido por temperaturas que excedan los 300 °C. Ambos estiman que el desarrollo a partir de un genoma de 100 kilobases de un heterótrofo primitivo de ADN/proteínas hasta la generación de un genoma de 7000 genes de una cianobacteria filamentosa hubiera requerido solo 7 millones de años.[17] Lagunas hidrotermales fluctuantes en islas volcánicas o proto-continentesLas células contienen concentraciones de potasio, fosfato y metales de transición mucho más altas que las existentes en océanos, lagos o ríos, ya sean estos actuales o primitivos (reconstruidos). De este modo, es más parsimonioso considerar que las primeras células se originaron en ambientes con concentraciones químicas similares a las halladas en los citoplasmas.[18] Armid Munkidjanian y colaboradores piensan que los ambientes marinos no suministraron el balance iónico y la composición universalmente conocida en las células, así como también los iones requeridos por proteínas esenciales y ribozimas encontradas en todos los organismos vivos, especialmente con respecto la relación K+/Na+ y las concentraciones de Mn2+, Zn2+ y fosfatos.[18] El único ambiente conocido que presenta las condiciones adecuadas en la Tierra, está representado por las lagunas hidrotermales terrestres alimentados por fumarolas.[19] Los depósitos minerales en estos ambientes, que se encontraban bajo una atmósfera anóxica (como la hallada en el pasado remoto), pudieron tener un pH adecuado, como contraposición a las lagunas hidrotermales actuales en una atmósfera oxigenada. Estas lagunas contendrían precipitados de minerales de sulfuro que bloquea la radiación UV dañina. Tendrían también ciclos de humedad/aridez que concentran sus soluciones de sustratos para concentraciones susceptibles a formaciones espontáneas de polímeros de ácidos nucleicos, y un suministro continuo de moléculas orgánicas generadas abióticamente, ambas por reacciones químicas en ambientes hidrotermales, así como también por exposición a rayos UV durante el transporte de fumarolas a lagunas adyacentes. Sus ambientes pre-bióticos hipotetizados son similares a los ambientes de chimeneas hidrotermales de las profundidades oceánicas también hipotéticos, pero agregan componentes adicionales que ayudan a explicar peculiaridades encontradas en reconstrucciones del último antepasado común universal (LUCA, por sus siglas en inglés, Last Universal Common Ancestor) de todos los organismos vivientes.[18] Bruce Damer y David Deamer llegaron a la conclusión de que las membranas de las células no pueden ser formadas en agua de mar, y por lo tanto deben haberse originado en agua dulce. Antes de la formación de los continentes, la única porción de tierra no cubierta por agua, pudieron ser islas volcánicas, donde la lluvia forma lagunas en las que los lípidos pudieron constituir los primeros estadios de membranas celulares. Este predecesor de las células verdaderas se asume que habría tenido un comportamiento más parecido a superorganismos que a estructuras individuales, en los que la transmisión de macromoléculas entre proto-células habría sido común. Según los autores, estas células podrían haber evolucionado gradualmente para adaptarse a ambientes más salados y entrar en el océano.[20] Colín-García y colaboradores (2016) discuten las ventajas y desventajas de las fumarolas hidrotermales como ambientes primitivos.[19][21] Ellos mencionan las reacciones exergónicas, en las cuales los sistemas pueden tener una fuente de energía libre que promueve las reacciones químicas, adicionalmente a su alta diversidad mineralógica la cual implica la introducción de importantes gradientes químicos, favoreciendo así la interacción entre electrones donantes y receptores. Estos autores también resumen una serie de experimentos propuestos para comprobar el rol de las fumarolas hidrotermales en la síntesis prebiótica.[21] Evidencia de vida temprana en las fuentes hidrotermales más antiguas de la TierraEl hallazgo de restos de microorganismos en rocas sedimentarias ferruginosas del cinturón de Nuvvuagittuq en Quebec, Canadá, de entre 3700 y 4280 millones de años, ha proporcionado la evidencia directa de una de las formas de vida más antiguas de la Tierra.[1] Los investigadores interpretan, basándose en evidencias químicas y morfológicas, que se trata de restos de bacterias filamentosas que metabolizan el hierro, y por lo tanto representan las formas de vida más antiguas reconocidas en la Tierra. Estas rocas sedimentarias, que se encuentran entre las más antiguas conocidas, probablemente formaban parte de un sistema de ventilación hidrotermal rico en hierro que proporcionaba un hábitat para las primeras formas de vida de la Tierra. Las estructuras halladas en estas rocas se presentan como filamentos diminutos y tubos, compuestos de hematita, con morfologías similares a las ramificaciones características de las bacterias oxidantes de hierro que se encuentran cerca de fuentes hidrotermales actuales. Éstas se hallaron junto a grafito y minerales de apatita y carbonatos, en estructuras esféricas que en rocas jóvenes suelen contener restos de seres vivos. Se piensa que la hematita se formó cuando las bacterias que oxidan el hierro fueron fosilizadas en la roca. El hallazgo resulta valioso debido a que hasta el momento no se había confirmado el hallazgo de microfósiles más antiguos que 3500 millones de años, y por ello el conocimiento del tema estaba basado en evidencias indirectas tales como huellas químicas y la composición isotópica del material carbonoso. Los autores rechazan el origen no biogénico de estas estructuras, mediante estiramientos metamórficos o procesos diagenéticos, tales como reacciones de precipitación y autoensamblaje durante el enterramiento de los sedimentos. Sin embargo, ningún mecanismo puede permitir el crecimiento de múltiples tubos a partir de un solo nódulo de hematita durante reacciones metamórficas, junto con la formación de filamentos internos, además de su estrecha asociación espacial con carbonato y carbono grafítico. Composición de la atmósfera, los océanos y la corteza terrestre en el eón HadeicoLa acreción y formación de la Tierra tuvo que haber tenido lugar en algún momento hace 4500 a 4600 millones de años, según diferentes métodos radiométricos.[22] La diferenciación del manto terrestre, a partir de análisis de la serie samario-neodimio en rocas de Isua, Groenlandia, pudo haber sido bastante veloz, tal vez en menos de 100 millones de años.[23] Posteriores estudios confirman esta formación temprana de las capas de silicatos terrestres.[24] Se ha sugerido que los océanos podrían haber aparecido en el eón Hadeico tan pronto como 200 millones de años después de la formación de la Tierra,[25] en un ambiente caliente (100 °C) y reductor y con un pH inicial de 5,8 que subió rápidamente hacia la neutralidad. Esta idea ha sido apoyada por Wilde[26] quien elevó la datación de los cristales de zircón encontrados en cuarcitas metamorfizadas del terrane de gneis del Monte Narryer, en Australia occidental, del que previamente se pensaba que era de 4100-4200 millones de años a 4402 millones de años. Otros estudios realizados más recientemente en el cinturón de basalto de Nuvvuagittuq, al norte de Quebec, empleando neodimio-142 confirman, estudiando rocas del tipo falsa anfibolita (cummingtonita-anfibolita), la existencia muy temprana de una corteza, con una datación de 4360 millones de años.[27] Esto significa que los océanos y la corteza continental existieron dentro de los 150 primeros millones de años tras la formación de la Tierra. A pesar de esto, el ambiente hadeico era enormemente hostil para la vida. Se habrían dado frecuentes colisiones con grandes objetos cósmicos, incluso de más de 500 kilómetros de diámetro, suficientes para vaporizar el océano durante meses tras el impacto, lo que formaría nubes de vapor de agua mezclado con polvo de rocas elevándose a altitudes que cubrirían todo el planeta. Tras unos cuantos meses la altitud de esas nubes comenzaría a disminuir, pero la base de la nube continuaría aun estando elevada probablemente durante los siguientes mil años, tras lo cual comenzaría a llover a una altitud más baja. Durante 2000 años las lluvias consumirían lentamente las nubes, devolviendo los océanos a su profundidad original solo 3000 años tras el impacto.[28] El posible bombardeo intenso tardío provocado probablemente por los movimientos posicionales de los planetas gaseosos gigantes, que acribillaron la Luna y otros planetas interiores (Mercurio, Marte y, posiblemente, la Tierra y Venus) hace 3800 a 4100 millones de años probablemente habrían esterilizado el planeta si la vida ya hubiera aparecido en ese periodo. Biogénesis en ambiente cálido contra fríoSi se examinan los periodos libres de cataclismos producidos por impactos de meteoros que impedirían el establecimiento de protoorganismos autorreplicantes, la vida pudo haberse desarrollado en diferentes ambientes primitivos. El estudio llevado a cabo por Maher y Stephenson[29] muestra que, si los sistemas hidrotermales marinos profundos propician un lugar aceptable para el origen de la vida, la abiogénesis pudo haber sucedido hace 4000 y 4200 millones de años, mientras que si hubiera sucedido en la superficie de la Tierra, la abiogénesis solo podría haber ocurrido hace 3700 o 4000 millones de años. Otros trabajos de investigación sugieren un comienzo de la vida más frío. Los trabajos de Stanley Miller mostraron que las bases nitrogenadas adenina y guanina requieren condiciones de congelación para su síntesis, mientras que la citosina y el uracilo precisan temperaturas de ebullición.[30] Basándose en estas investigaciones sugirió que el origen de la vida implicaría condiciones de congelación y meteoritos impactando.[31] Un artículo de la publicación Discover Magazine señala hacia la investigación de Stanley Miller indicando que se pueden formar siete aminoácidos diferentes y 11 tipos de nucleobases en hielo, como cuando se dejó amoníaco y cianuro en el hielo antártico entre 1972 y 1997,[32] así como a la investigación llevada a cabo por Hauke Trinks mostrando la formación de moléculas de ARN de 400 bases de longitud en condiciones de congelación utilizando un molde de ARN (una cadena sencilla de ARN que guía la formación de una nueva cadena). A medida que la nueva cadena de ARN crecía, los nuevos nucleótidos se iban adhiriendo al molde.[33] La explicación dada para la inusitada velocidad de estas reacciones a semejante temperatura es que se trataba de una congelación eutéctica. A medida que se forman cristales de hielo, este permanece puro: solo las moléculas de agua se unen al cristal en crecimiento, mientras que las impurezas como la sal o el cianuro quedan excluidas. Estas impurezas acaban apiñadas en bolsillos microscópicos de líquido entre el hielo, y es esta concentración lo que hace que las moléculas choquen entre sí con más frecuencia.[34] Modelos hipotéticos del origen de la vidaHipótesis de EigenA principios de los años 1970 se organizó una gran ofensiva al problema del origen de la vida por un equipo de científicos reunidos en torno a Manfred Eigen, del instituto Max Planck. Intentaron examinar los estados transitorios entre el caos molecular de una sopa prebiótica y los estados transitorios de un hiperciclo de replicación y entre el caos molecular en una sopa prebiótica y sistemas macromoleculares autorreproductores simples. En un hiperciclo, el sistema de almacenamiento de información (posiblemente ARN) produce una enzima, que cataliza la formación de otro sistema de información en secuencia hasta que el producto del último ayuda a la formación del primer sistema de información. Con un tratamiento matemático, los hiperciclos pueden crear cuasiespecies, que a través de selección natural entraron en una forma de evolución darwiniana. Un impulso a la teoría del hiperciclo fue el descubrimiento de que el ARN, en ciertas circunstancias, se transforma en ribozimas (una forma de enzima de ARN) capaces de catalizar sus propias reacciones químicas. Modelos «primero los ácidos nucleicos»: el mundo de ARN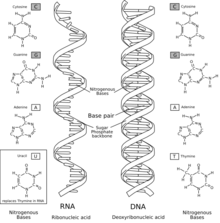 La hipótesis del mundo de ARN fue enunciada por Walter Gilbert, de Harvard, con base en los experimentos de Thomas Cech (Universidad de Colorado) y Sidney Altman (Yale) en 1980.[35] Sugiere que las moléculas relativamente cortas de ARN se podrían haber formado espontáneamente de modo que fueran capaces de catalizar su propia replicación continua. Es difícil de calibrar la probabilidad de esta formación. Se han expuesto algunas hipótesis de cómo pudo haber sucedido. Las primeras membranas celulares pudieron haberse formado espontáneamente a partir de proteinoides (moléculas similares a proteínas que se producen cuando se calientan soluciones de aminoácidos). Cuando están presentes a la concentración correcta en solución acuosa, forman microesferas que, según se ha observado, presentan una conducta similar a los compartimentos rodeados de membrana.[36] Otras posibilidades incluyen sistemas de reacciones químicas que tienen lugar en el interior de sustratos de arcilla o en la superficie de rocas piríticas. Entre los factores que apoyan un papel importante para el ARN en la vida primitiva se incluye su habilidad para replicar (véase el Monstruo de Spiegelman); su habilidad para actuar tanto para almacenar información y catalizar reacciones químicas (como ribozimas); su papel extremadamente importante como intermediario en la expresión y mantenimiento de la información genética (en forma de ADN) en los organismos modernos y en la facilidad de su síntesis química o al menos de los componentes de la molécula bajo las condiciones aproximadas de la Tierra primitiva. Se han producido artificialmente en el laboratorio moléculas de ARN relativamente cortas capaces de duplicar a otras.[37] Debido a que el ARN puede realizar las tareas del ADN y las enzimas, se cree que alguna vez fue capaz de sustentar formas de vida independientes. Algunos virus utilizan ARN como material genético, en lugar de ADN. Además, aunque no se encontraron nucleótidos en el experimento de Urey-Miller, su formación en condiciones prebióticas se informó en 2009. La base conocida como adenina es simplemente un pentámero de cianuro de hidrógeno. Los experimentos con ribozimas básicas, como el ARN del bacteriófago Qβ, han demostrado que las estructuras de ARN autorreplicantes simples pueden resistir incluso fuertes presiones selectivas (por ejemplo, terminadores de cadena de quiralidad opuesta).[38] Los ribonucleósidos de pirimidina y sus respectivos nucleótidos se han sintetizado prebióticamente mediante una secuencia de reacciones que pasan por alto los azúcares libres y se ensamblan de manera escalonada al incluir químicas nitrogenadas y oxigenadas. En una serie de publicaciones, John Sutherland y su equipo de investigadores demostraron rutas de alto rendimiento para los ribonucleótidos de citidina y uridina construidos a partir de pequeños fragmentos de 2 y 3 carbonos, como glicolaldehído, gliceraldehído o gliceraldehído-3. -fosfato, cianamida y cianoacetileno. Uno de los pasos de esta secuencia permite el aislamiento deenantiopure ribosa aminooxazolina si el exceso enantiomérico de gliceraldehído es del 60% o más, de posible interés hacia la homoquiralidad biológica. Esto puede verse como una etapa de purificación prebiótica, en la que dicho compuesto cristalizó espontáneamente a partir de una mezcla de las otras pentosas aminooxazolinas. Las aminooxazolinas pueden reaccionar con cianoacetileno de una manera suave y altamente eficiente, controlada por fosfato inorgánico, para dar ribonucleótidos de citidina. La fotoanomerización con luz ultravioleta permite la inversión alrededor del centro anomérico 1 'para dar la estereoquímica beta correcta; un problema con esta química es la fosforilación selectiva de alfa-citidina en la posición 2 '. Sin embargo, en 2009, demostraron que los mismos bloques de construcción simples permiten el acceso, a través de la elaboración de nucleobase controlada por fosfato, a nucleótidos de pirimidina cíclica 2 ', 3'-directamente, que se sabe que pueden polimerizar en ARN. La química orgánica de Donna Blackmond describió este hallazgo como "evidencia sólida" a favor del mundo del ARN. Sin embargo, John Sutherland dijo que si bien el trabajo de su equipo sugiere que los ácidos nucleicos desempeñaron un papel temprano y central en el origen de la vida, no necesariamente respaldaba la hipótesis del mundo del ARN en sentido estricto, que describió como un "restrictivo, arreglo hipotético".[39][40][41][42] El artículo de 2009 del grupo Sutherland también destacó la posibilidad de fotodesinfección de los fosfatos pirimidina-2 ', 3'-cíclicos. Una debilidad potencial de estas rutas es la generación de gliceraldehído enantio enriquecido, o su derivado 3-fosfato (el gliceraldehído prefiere existir como su cetotautómero dihidroxiacetona).[43] Un punto de vista ligeramente distinto sobre esta misma hipótesis es la de que un tipo diferente de ácido nucleico nombrado pre-ARN, como el ácido nucleico peptídico (ANP), ácido nucleico treósico (ANT) así como el ácido nucleico glicólico (ANG) fueron los primeros en emerger como moléculas autorreplicativas para ser reemplazadas por el ARN solo después.[44][45] Tras haber surgido el ARN, este precedería al ADN a través de la retrotranscripción, argumento que ha sido demostrado experimentalmente. En las células modernas los precursores del ADN (los cuatro desoxirribonucleótidos, dNTP) se producen por reducción de ribonucleótidos di o trifosfato por ribonucleótido reductasa, por tanto se concluyó que el origen prebiótico del ADN fue a partir de acetaldehído y gliceraldehído-5-fosfato de ARN. También la aparición del ADN requirió la presencia de polimerasas, principalmente la transcriptasa inversa y proteínas de unión a ácidos nucleicos. Tanto la biosíntesis de purina como la de pirimidina se construyen sobre la ribosa 5 monofosfato como un precursor común del ADN. El primer paso en la aparición del ADN fue la formación de ADN-U (ADN que contiene uracilo), algunos virus ADN bicatenario (principalmente bacteriófagos) retienen genomas con ADN-U, reflejando este primer paso de transición entre el ARN y el ADN. Más adelante el uracilo se perdería dando lugar al ADN común denominado ADN-T.[46][47] Por otro lado, el ARN no precedió a las proteínas ya que estas provendrían de péptidos, por lo que actualmente se considera que el ARN y las proteínas coevolucionaron hasta unirse y formar los ribosomas, polimerasas y demás proteínas de unión a ácidos nucleicos.[48][49] Aún quedan algunos problemas con la hipótesis del mundo de ARN, en particular la inestabilidad del ARN cuando se expone a la radiación ultravioleta, la dificultad de activar y ligar los nucleótidos y la carencia de fosfato disponible en solución requerida para construir su columna vertebral y la inestabilidad de la base citosina (que es susceptible a la hidrólisis). Recientes experimentos también sugieren que las estimaciones originales del tamaño de una molécula de ARN capaz de autorreplicación eran muy probablemente ampliamente subestimadas.[cita requerida] Modelos «primero el metabolismo»: el mundo de hierro-azufre y otros  Algunos modelos rechazan la idea de la autorreplicación de un «replicón egoísta» y postulan la emergencia de un metabolismo primitivo que pudo proporcionar un ambiente para la posterior emergencia de la replicación del ARN y el ADN. Una de las más tempranas encarnaciones de esta idea fue presentada en 1924 por la noción de Alexander Oparin de primitivas vesículas autorreplicantes que precedieron al descubrimiento de la estructura del ADN. Las variantes más recientes de los años 1980 y 1990 incluyen la teoría del mundo de hierro-azufre de Günter Wächtershäuser y modelos presentados por Christian de Duve basados en la química de los tioésteres.[51] Entre algunos modelos más abstractos y teóricos de la plausibilidad de la emergencia del metabolismo sin la presencia de genes se incluye un modelo matemático presentado por Freeman Dyson a principios de los años 1980 y la noción de Stuart Kauffman de conjuntos colectivamente autocatalíticos, discutidos ya avanzada la década. Otra posible respuesta a este misterio de la polimerización fue propuesta por Günter Wächtershäuser en 1980, en su teoría del hierro-azufre. En esta teoría, postuló la evolución de las rutas (bio) químicas como el fundamento de la evolución de la vida. Incluso presentó un sistema consistente para rastrear las huellas de la actual bioquímica desde las reacciones ancestrales que proporcionaban rutas alternativas para la síntesis de «ladrillos orgánicos» a partir de componentes gaseosos simples.[52] Al contrario que los experimentos clásicos de Miller, que dependían de fuentes externas de energía (como relámpagos simulados o radiación UV), los «sistemas de Wächstershäuser» vienen con una fuente de energía incorporada, los sulfuros de hierro y otros minerales como la pirita. La energía liberada a partir de las reacciones redox de esos sulfuros metálicos, no solo estaba disponible para la síntesis de moléculas orgánicas, sino también para la formación de oligómeros y polímeros. Se lanza por ello la hipótesis de que tales sistemas podrían ser capaces de evolucionar hasta formar conjuntos autocatalíticos de entidades autorreplicantes metabólicamente activas que serían los precursores de las actuales formas de vida.[53][54] El experimento tal y como fue llevado a cabo rindió una producción relativamente pequeña de dipéptidos (de 0,4% a 12,5%) y una producción inferior de tripéptidos (0,003%) y los autores advirtieron que «bajo estas mismas condiciones los dipéptidos se hidrolizaban rápidamente.»[55] Otra crítica del resultado es que el experimento no incluía ninguna organomolécula que pudiera con mayor probabilidad dar reacciones cruzadas o terminar la cadena (Huber y Wächsterhäuser, 1998). En 1997, Wächtershäuser y Claudia Huber mezclaron monóxido de carbono, sulfuro de hidrógeno y partículas de sulfuro de níquel a 100 °C y demostraron que se podían generar aminoácidos.[56] Al año siguiente, utilizando los mismos ingredientes, fueron capaces de producir péptidos.[57] La más reciente modificación de la teoría del hierro-azufre fue propuesta por William Martin y Michael Russell en 2002.[58] De acuerdo con su escenario, las primeras formas celulares de vida pudieron haber evolucionado dentro de las llamadas «chimeneas negras» en las profundidades donde se encuentran las zonas de expansión del fondo oceánico. Estas estructuras consisten en cavernas a microescala que están revestidas por delgadas paredes membranosas de sulfuros metálicos. Por tanto, estas estructuras resolverían varios puntos críticos de los sistemas de Wächstershäuser de una sola vez:[59][60]
Este modelo sitúa al último antepasado común universal (LUCA, del inglés Last Universal Common Ancestor) dentro de una chimenea negra, en lugar de asumir la existencia de una forma de vida libre de LUCA. El último paso evolutivo sería la síntesis de una membrana lipídica que finalmente permitiera al organismo abandonar el sistema en el interior de la microcaverna de las chimeneas negras y comenzar su vida independiente. Este postulado de una adquisición tardía de los lípidos es consistente con la presencia de tipos completamente diferentes de lípidos de membrana en arqueas y bacterias (más los eucariotas) con una fisiología altamente similar en todas las formas de vida en otros aspectos.[61] De acuerdo con Leslie Orgel, un líder en los estudios sobre el origen de la vida durante algunas de las pasadas décadas, hay razones para creer que la afirmación permanecerá así. En un artículo titulado Self-Organizing Biochemichal Cycles,[62] Orgel resume su análisis de la propuesta estipulando que «por ahora no existe razón para esperar que ciclos de múltiples pasos como el ciclo reductor del ácido cítrico pudiera autoorganizarse en la superficie de FeS/FeS2 o de algún otro mineral». Es posible que otro tipo de ruta metabólica fuera usado en los comienzos de la vida. Por ejemplo, en lugar del ciclo reductivo del ácido cítrico, la ruta abierta del acetil-CoA (otra de las cuatro vías reconocidas de fijación de dióxido de carbono en la naturaleza) podría ser más compatible con la idea de autoorganización en una superficie de sulfuro metálico. La enzima clave de esta vía, monóxido de carbono deshidrogenasa/acetil-CoA tiene anclados grupos mixtos de sulfuro de hierro y níquel en sus centros de reacción y cataliza la formación de acetil-CoA (que podría ser recordado como una forma moderna de acetilo-tiol) en un único paso. Otro asunto sin resolver en la evolución química es el origen de la homoquiralidad. Por ejemplo, todos los monómeros tienen la misma «rotación dominante» (los aminoácidos son levógiros y los ácidos nucleicos y azúcares son dextrógiros). La homoquiralidad es esencial para la formación de ribozimas funcionales (y probablemente también de proteínas). El origen de la homoquiralidad podría explicarse simplemente por una asimetría inicial por casualidad seguida de una descendencia común.[63] Los trabajos llevados a cabo en 2003 por científicos de Purdue identificaron el aminoácido serina como la probable raíz que provoca la homoquiralidad de las moléculas. La serina produce enlaces particularmente fuertes con los aminoácidos de la misma quiralidad, lo cual resulta en un grupo de ocho moléculas que podrían todas ella ser dextrógiras o levógiras. Esta propiedad se contrapone a la de otros aminoácidos que son capaces de formar enlaces débiles con los aminoácidos de quiralidad opuesta. Aunque el misterio de por qué acabó siendo dominante la serina aún está sin resolver, los resultados sugieren una respuesta a la cuestión de la transmisión quiral: el cómo las moléculas orgánicas de una quiralidad mantienen la dominancia una vez que se establece la asimetría.[64][64] Patel en 2016 tras un experimento sugirió que los lípidos, péptidos (precursores de las proteínas) y el pre-ARN (ácido nucleico precursor del ARN y este último del ADN) se derivaron de un protometabolismo de cianuro de hidrógeno al demostrarse que los precursores de sus componentes; los nucleótidos, aminoácidos y lípidos pueden derivarse todos de la homologación reductora del cianuro de hidrógeno y algunos de sus derivados y, por tanto, todos los subsistemas celulares podrían haber surgido simultáneamente a través de la química común. Los pasos clave de la reacción son impulsados por luz ultravioleta, usan sulfuro de hidrógeno como reductor y pueden acelerarse mediante ciclos fotorredox Cu (I) -Cu (II).[65] Modelos híbridos: el mundo de ARN-péptidoUna creciente comprensión de los fallos de los modelos que consideran puramente «primero los ácidos nucleicos» o «primero el metabolismo» está llevando a tendencias hacia modelos que incorporan aspectos de ambos. Concretamente, y basándose en la implausibilidad logística del modelo de mundo de ARN, Robert Griffith ha establecido un modelo de cooperación entre el ARN, los primitivos péptidos y lípidos cuya secuencia sería como sigue: la materia orgánica generada mediante síntesis abiótica en los océanos primitivos se separaría en fases por densidad y solubilidad. La síntesis de monómeros complejos y también de polímeros tendría lugar en superficies hidrofílicas y en sus proximidades (interfases) tanto con el medio acuoso como aéreo. La replicación y la traducción encontrarían su lugar idóneo en la interfase de elementos emulsificados de carácter hidrofóbico. Los primeros ácidos nucleicos codificarían preferentemente arginina. Estos péptidos enriquecidos en arginina servirían para secuestrar y transferir enlaces de fosfato ricos en energía. Esto haría que los péptidos fueran esenciales para el mantenimiento de los ácidos nucleicos, ricos en fosfato, y al mismo tiempo los mantendrían cerca de las interfases lipídicas.[66] Esta teoría se llama coevolución de ARN-péptido, o el mundo de ARN-péptido, y ofrece una posible explicación para la rápida evolución de la replicación de alta calidad en el ARN (dado que las proteínas son catalizadores), con la desventaja de tener que postular la formación coincidente de dos moléculas complejas, una enzima (a partir de péptidos) y un ARN (de nucleótidos). El estudio deja abierta la pregunta de cómo exactamente esos sistemas primitivos lograron replicarse a sí mismos, algo que ni la hipótesis del mundo del ARN ni la hipótesis del mundo del ARN-péptido pueden explicar todavía, a menos que las polimerasas (enzimas que ensamblan rápidamente la molécula de ARN) jugaron un papel.[67][68][69] Un proyecto de investigación completado en marzo de 2015 descubrió que una red de reacciones que comienzan con cianuro de hidrógeno y sulfuro de hidrógeno, en corrientes de agua irradiadas con luz ultravioleta, podrían producir los componentes químicos de proteínas y lípidos, junto con los del ARN. Los investigadores utilizaron el término "cianosulfídico" para describir esta red de reacciones. En noviembre de 2017, un equipo del Instituto de Investigación Scripps identificó reacciones que involucraban al compuesto diamidofosfato que podrían haber vinculado los componentes químicos en cadenas cortas de péptidos y lípidos, así como cadenas cortas de nucleótidos similares al ARN.[70][71][72] Teoría de la playa radiactivaZachary Adam,[73] de la Universidad de Washington en Seattle, afirma que procesos mareales mayores que los actuales, producidos por una luna situada a una distancia mucho menor podrían haber concentrado partículas radiactivas de uranio y otros elementos radiactivos en la marea alta en las playas primordiales donde debieron haber sido los responsables de generar los componentes elementales de la vida. De acuerdo con los modelos de computación publicados en Astrobiology[74] un depósito de tales materiales radiactivos podría haber mostrado la misma reacción nuclear autosostenida que se encuentra en el yacimiento de uranio de Oklo, en Gabón. Esta arena radiactiva proporciona suficiente energía para generar moléculas orgánicas, como aminoácidos y azúcares a partir de acetonitrilo procedente del agua. La monacita radiactiva también libera fosfatos solubles en las regiones que se encuentran entre los granos de arena, haciéndolos biológicamente accesibles. Así pues los aminoácidos, azúcares y fosfatos solubles pueden ser producidos simultáneamente, de acuerdo con Adam. Los actínidos radiactivos, que entonces se encontraban en mayores concentraciones, pudieron haber formado parte de complejos órgano-metálicos. Estos complejos pudieron haber sido importantes como primeros catalizadores en los procesos de la vida. John Parnell, de la Universidad de Aberdeen, sugiere que tales procesos formaron parte del «crisol de la vida» en los comienzos de cualquier planeta rocoso hasta que este fuera lo suficientemente grande para generar un sistema de tectónica de placas que aportara minerales radiactivos a la superficie. Puesto que se cree que la Tierra en sus orígenes estaba formada por muchas «microplacas», se darían condiciones favorables para este tipo de procesos. HomoquiralidadAlgunos procesos de la evolución química deberían explicar el origen de la homoquiralidad, es decir, el hecho de que casi todos los componentes elementales de los seres vivos tienen la misma quiralidad, siendo los aminoácidos levógiros, los azúcares ribosa y desoxirribosa de los ácidos nucleicos son dextrógiros, así como los fosfoglicéridos quirales. Se pueden sintetizar moléculas quirales, pero en ausencia de una fuente de quiralidad o de un catalizador quiral se forman en una mezcla 50/50 de ambos enantiómeros, a la cual se le llama mezcla racémica. Clark sugirió que la homoquiralidad pudo comenzar en el espacio, puesto que los estudios sobre los aminoácidos del meteorito Murchison mostraron que la L-alanina era dos veces más frecuente que la forma D, y el ácido L-glutámico era 3 veces más prevalente que su contrapartida dextrógira. Se ha sugerido que la luz polarizada tuvo el poder de destruir uno de los enantiómeros dentro del disco protoplanetario. Noyes ha demostrado que la desintegración beta provocaba la destrucción de la D-leucina en una mezcla racémica y que la presencia de 14C, presente en grandes cantidades en las sustancias orgánicas del ambiente temprano de la tierra, podría haber sido la causa.[75] Robert M. Hazen ha publicado informes de experimentos realizados en distintas superficies cristalinas quirales que actuaban como posibles lugares de concentración y ensamblaje de monómeros quirales en macromoléculas.[76] Una vez estabilizado el sistema, la quiralidad podría haber sido seleccionada favorablemente por la evolución.[77] Los trabajos con compuestos orgánicos encontrados en meteoritos tienden a sugerir que la quiralidad es una característica de la síntesis abiogénica, puesto que los aminoácidos actuales son levógiros, mientras que los azúcares son predominantemente dextrógiros.[78] Un trabajo llevado a cabo en 2003 por científicos de Purdue identificaron el aminoácido serina como la probable raíz causal de la homoquiralidad de las moléculas orgánicas.[79] La serina forma enlaces particularmente fuertes con los aminoácidos de la misma quiralidad, lo cual resulta en un grupo de ocho moléculas que deben ser todas o bien dextrógiras o levógiras. Esta propiedad contrasta con otros aminoácidos que son capaces de formar enlaces débiles con los aminoácidos de la quiralidad opuesta. Aunque el misterio de por qué la serina levógira acabó siendo la dominante aún permanece sin resolver, estos resultados sugieren una respuesta a la cuestión de la transmisión quiral: cómo las moléculas orgánicas de una quiralidad mantienen la dominancia una vez que la asimetría ha sido establecida. Autoorganización y replicaciónSi se considera, como a menudo sucede, que la autoorganización y autorreplicación son los procesos principales que caracterizan a los sistemas vivos, hay que decir que hay muchos tipos de moléculas abióticas que exhiben estas características en las condiciones adecuadas. Por ejemplo, Martin y Russel mostraron que la formación de un compartimento distinto del ambiente por membranas celulares y la autoorganización de reacciones redox autocontenidas son los atributos más conservados entre los seres vivos, y esto les lleva a argumentar que la materia inorgánica con estos atributos podrían estar entre los atributos más probables del antepasado común de todos los seres vivos.[80] Formación y organización de los protobiontes La compartimentación fue importante para el origen de la vida. Las membranas forman compartimientos cerrados que están separados del ambiente externo, proporcionando así al protobionte espacios acuosos funcionalmente especializados. Como la bicapa lipídica de las membranas es impermeable a la mayoría de las moléculas hidrófilas (disueltas en agua), las células tienen sistemas de transporte de membranas que logran la importación de moléculas nutritivas así como la exportación de desechos. Es muy difícil construir protobiontes a partir de ensamblajes moleculares. Un paso importante en este desafío es el logro de la dinámica de las vesículas que son relevantes para las funciones celulares, como el tráfico de membranas y la autorreproducción, utilizando moléculas anfifílicas. En la Tierra primitiva, numerosas reacciones químicas de compuestos orgánicos produjeron los ingredientes de la vida. De estas sustancias, las moléculas anfifílicas podrían ser el primer jugador en la evolución del ensamblaje molecular a la vida celular. Un paso de la vesícula a protobionte podría ser el desarrollo de vesículas autorreproductoras junto con el sistema metabólico.[81][82] Los protobiontes fueron estructuras lipídicas formadas por una sola membrana compuestas de ARN y proteínas, de tamaño nanómetrico, probablemente hayan tenido características vitales como reproducción asexual y capacidades metabólicas.[83][84] Fueron evolucionando a células al unirse más liposomas o vesículas cercanas sobre su única membrana lo cual llevó al desarrollo de una estructura más compleja que les permitiese proteger su material genético y proteínas, durante esta transición desarrollaron el ADN a partir del ARN como material genético. Al pasar esta etapa los protobiontes dieron origen al último antepasado común universal al desarrollar las características universales de las células como citoplasma, citoesqueleto, membrana plasmática y pared celular.[85] El último antepasado común universal (LUCA) fue un organismo procariota osmótrofo que posteriormente originaria al linaje bacteriano y al linaje arqueo-eucarionte. Modelos de formaciónCuando los fosfolípidos se colocan en agua, las moléculas se organizan espontáneamente de manera que las colas quedan protegidas por el agua, lo que da como resultado la formación de estructuras de membrana como bicapas, vesículas y micelas. En las células modernas, las vesículas participan en el metabolismo, el transporte, el control de la flotabilidad y el almacenamiento de enzimas. También pueden actuar como cámaras de reacción química natural. Una vesícula o micela típica en solución acuosa forma un agregado con las regiones de "cabeza" hidrófila en contacto con el solvente circundante, secuestrando el hidrófobo de cola única en el centro de la micela. Esta fase es causada por el comportamiento de empaquetamiento de los lípidos de una sola cola en una bicapa. Aunque el proceso de autoensamblaje protobionte que forma espontáneamente vesículas y micelas de monocapa lipídica en la naturaleza se asemeja a los tipos de vesículas o protobiontes primordiales que podrían haber existido al comienzo de la evolución, no son tan sofisticadas como las membranas bicapa de los organismos vivos de hoy.[86][87] Sin embargo, en lugar de estar compuestas por fosfolípidos, las primeras membranas pueden haberse formado a partir de monocapas o bicapas de ácidos grasos, que pueden haberse formado más fácilmente en un entorno prebiótico. Los ácidos grasos se han sintetizado en laboratorios bajo una variedad de condiciones prebióticas y se han encontrado en meteoritos, lo que sugiere su síntesis natural en la naturaleza.[88] Las vesículas de ácido oleico representan buenos modelos de protobiontes de membrana que podrían haber existido en tiempos prebióticos.[89] Las interacciones electrostáticas inducidas por péptidos hidrófobos cortos, cargados positivamente, que contienen 7 aminoácidos de longitud o menos, pueden unir ácidos nucleicos a la membrana de una vesícula, la membrana celular básica.[90][91] Estanques geotermales y arcillasLos científicos han sugerido que los protobiontes se originaron en respiraderos hidrotermales en las profundidades del mar. Un estudio de 2012 sugiere que las piscinas interiores de vapor geotérmico condensado y enfriado tienen las características ideales para la formación de protobiontes. La conclusión se basa principalmente en la química de las células modernas, donde el citoplasma es rico en iones de potasio, zinc, manganeso y fosfato, que no están muy extendidos en los ambientes marinos. Tales condiciones, argumentan los investigadores, se encuentran solo donde el fluido hidrotermal caliente trae los iones a la superficie, lugares como géiseres, ollas de barro, fumarolas y otras fuentes geotérmicas características. Dentro de estas cuencas humeantes y burbujeantes, el agua cargada de iones de zinc y manganeso podría haberse acumulado, enfriado y condensado en piscinas poco profundas.[92] Otro estudio en la década de 1990 mostró que la arcilla de montmorillonita puede ayudar a crear cadenas de ARN de hasta 50 nucleótidos unidas espontáneamente en una sola molécula de ARN. Más tarde, en 2002, se descubrió que al agregar montmorillonita a una solución de micelas de ácidos grasos (esferas lipídicas), la arcilla aceleraba la tasa de formación de vesículas en 100 veces.[93] Las investigaciones han demostrado que algunos minerales pueden catalizar la formación escalonada de colas de hidrocarburos de ácidos grasos a partir de gases de hidrógeno y monóxido de carbono, gases que pueden haber sido liberados por respiraderos hidrotermales o géiseres. Los ácidos grasos de diversas longitudes se liberan eventualmente en el agua circundante, pero la formación de vesículas requiere una mayor concentración de ácidos grasos, por lo que se sugiere que la formación de protobiontes comenzó en respiraderos hidrotermales terrestres como géiseres, ollas de barro, fumarolas y otras características geotérmicas donde el agua se evapora y concentra el soluto.[94][95] Burbujas de montmorillonitaOtro grupo de investigadores sugiere que los protobiontes podrían haberse formado dentro de microcompartimientos de arcilla inorgánica, que pueden proporcionar un contenedor ideal para la síntesis y compartimentación de moléculas orgánicas complejas. Las burbujas con armadura de arcilla se forman naturalmente cuando las partículas de arcilla de montmorillonita se acumulan en la superficie exterior de las burbujas de aire bajo el agua. Esto crea una vesícula semipermeable a partir de materiales que están fácilmente disponibles en el medio ambiente. Los autores señalan que se sabe que la montmorillonita sirve como catalizador químico, lo que alienta a los lípidos a formar membranas y a los nucleótidos individuales a unirse en cadenas de ácidos nucleicos. Se puede imaginar una reproducción primitiva cuando las burbujas de arcilla estallan, liberando el producto ligado a la membrana lipídica al medio circundante.[96] Gotas sin membranaOtra forma de formar compartimentos primitivos que pueden conducir a la formación de un protobionte son las estructuras sin membrana de poliésteres que tienen la capacidad de albergar bioquímicos (proteínas y ácidos nucleicos) y anclar los conjuntos de lípidos a su alrededor.[97] Protobiontes de JeewanuLos protobiontes de Jeewanu son partículas químicas sintéticas que poseen una estructura similar a una célula y parecen tener algunas propiedades funcionales de la vida. Sintetizado por primera vez en 1963 a partir de minerales simples y orgánicos básicos mientras se expone a la luz solar, todavía se informa que tiene algunas capacidades metabólicas, la presencia de membrana semipermeable, aminoácidos, fosfolípidos, carbohidratos y moléculas de ácidos nucleicos. Sin embargo, la naturaleza y las propiedades de Jeewanu quedan por aclarar.[98] En un experimento de síntesis similar, una mezcla congelada de agua, metanol, amoníaco y monóxido de carbono se expuso a la radiación ultravioleta (UV). Esta combinación produjo grandes cantidades de material orgánico que se autoorganizó para formar glóbulos o vesículas cuando se sumergió en agua. El investigador consideró que estos glóbulos se asemejan a las membranas celulares que encierran y concentran la química de la vida, separando su interior del mundo exterior. Los glóbulos tenían entre 10 y 40 micrómetros (0,00039 a 0,00157 pulgadas), o aproximadamente el tamaño de los glóbulos rojos. Sorprendentemente, los glóbulos fluorescentes, o brillaba, cuando se expone a la luz ultravioleta. Absorber los rayos UV y convertirlos en luz visible de esta manera se consideró una forma posible de proporcionar energía a un protobionte. Si tales glóbulos jugaron un papel en el origen de la vida, la fluorescencia podría haber sido un precursor de la fotosíntesis primitiva. Dicha fluorescencia también proporciona el beneficio de actuar como filtro solar, difundiendo cualquier daño que de otra manera sería infligido por la radiación UV. Esta función protectora habría sido vital para la vida en la Tierra primitiva, ya que la capa de ozono, que bloquea los rayos ultravioleta más destructivos del sol, no se formó hasta que la vida fotosintética comenzó a producir oxígeno.[99][100] Transporte de membranaPara los organismos celulares, el transporte de moléculas específicas a través de las barreras de la membrana compartimentadas es esencial para intercambiar contenido con su entorno y con otros individuos. Por ejemplo, el intercambio de contenido entre individuos permite la transferencia horizontal de genes, un factor importante en la evolución de la vida. Si bien las células modernas pueden depender de complicadas maquinarias de proteínas para catalizar estos procesos cruciales, los protobiontes deben haberlo logrado utilizando mecanismos más simples.[101] Los protobiontes compuestos de ácidos grasos habrían podido intercambiar fácilmente pequeñas moléculas e iones con su entorno. Las membranas que constan de ácidos grasos tienen una permeabilidad relativamente alta a moléculas como el nucleósido monofosfato (NMP), nucleósido difosfato (NDP) y nucleósido trifosfato (NTP), y pueden resistir concentraciones milimolares de Mg2+. La presión osmótica también puede desempeñar un papel importante con respecto a este transporte pasivo de membrana.[102][103] Se ha sugerido que los efectos ambientales desencadenan condiciones en las que es posible el transporte de moléculas más grandes, como ADN y ARN, a través de las membranas de los protobiontes. Por ejemplo, se ha propuesto que la electroporación resultante de los rayos podría permitir dicho transporte. La electroporación es el rápido aumento de la permeabilidad bicapa inducida por la aplicación de un gran campo eléctrico artificial a través de la membrana. Durante la electroporación, las moléculas de lípidos en la membrana cambian de posición, abriendo un poro (agujero) que actúa como una vía conductora a través de la cual moléculas hidrófobas como los ácidos nucleicos pueden pasar la bicapa lipídica. Una transferencia similar de contenido a través de las protoceldas y con la solución circundante puede ser causada por la congelación y posterior descongelación. Esto podría ocurrir, por ejemplo, en un entorno en el que los ciclos diurnos y nocturnos provocan heladas recurrentes. Los experimentos de laboratorio han demostrado que tales condiciones permiten un intercambio de información genética entre poblaciones de protobiontes. Esto puede explicarse por el hecho de que las membranas son altamente permeables a temperaturas ligeramente por debajo de su temperatura de transición de fase. Si se alcanza este punto durante el ciclo de congelación-descongelación, incluso las moléculas grandes y muy cargadas pueden atravesar temporalmente la membrana del protobionte.[104][105] Algunas moléculas o partículas son demasiado grandes o demasiado hidrófilas para atravesar una bicapa lipídica incluso en estas condiciones, pero pueden moverse a través de la membrana mediante la fusión o gemación de vesículas, eventos que también se han observado en los ciclos de congelación-descongelación. Esto finalmente puede haber conducido a mecanismos que faciliten el movimiento de moléculas hacia el interior del protobionte (endocitosis) o que liberen su contenido al espacio extracelular (exocitosis).[106][107] Otros modelosTeoría de la burbujaLas olas que rompen en las costas crean una delicada espuma compuesta por burbujas. Los vientos que barren el océano tienen tendencia a llevar cosas a la costa, de forma similar a la madera que se junta a la deriva en una playa. Es posible que las moléculas orgánicas se pudieran concentrar en los bordes costeros de un modo parecido. Las aguas costeras más someras también tienden a ser más cálidas, concentrando más tarde las moléculas orgánicas por evaporación. Mientras las burbujas formadas mayormente por agua estallan rápidamente, sucede que las burbujas de grasas son mucho más estables, dándole más tiempo a cada burbuja en particular para llevar a cabo estos cruciales experimentos. Los fosfolípidos son un buen ejemplo de un compuesto graso que se cree que fue prevalente en los mares prebióticos. Debido a que los fosfolípidos contienen una cabeza hidrofílica en un extremo y una cola hidrofóbica en el otro, tienen tendencia a formar espontáneamente bicapas lipídicas en agua. Una burbuja de monocapa lipídica solo puede contener grasa y una burbuja de bicapa lipídica solo puede contener agua y fue un probable precursor de las modernas membranas celulares. Si una proteína acaba incrementando la integridad de su burbuja nodriza, entonces la burbuja tiene una gran ventaja y acaba situándose en la cúspide de la selección natural. La primitiva reproducción se podría visualizar cuando las burbujas estallaban, liberando el resultado del experimento en su medio circundante. Una vez que se libera una cantidad suficiente del «material correcto», el desarrollo de los primeros procariotas, eucariotas y organismos multicelulares se podía lograr.[108] De modo similar, las burbujas formadas completamente por moléculas similares a proteínas, llamadas microesferas, se formarían espontáneamente bajo las condiciones adecuadas. Pero no hay precursores probables de las modernas membranas celulares, puesto que las membranas celulares están compuestas primariamente de componentes lipídicos más que de componentes aminoacídicos. Un modelo propuesto por Fernando y Rowe[109] sugiere que el confinamiento de un metabolismo autocatalítico no-enzimático dentro de las protocélulas podría haber sido un modo de evitar el problema de las reacciones colaterales que son típicas de los modelos de «metabolismo primero». Teoría de la arcillaAlexander Graham Cairns-Smith, de la Universidad de Glasgow, presentó una hipótesis sobre el origen de la vida en 1985 basada en la arcilla y fue adoptada como una ilustración plausible por solo unos pocos científicos, incluyendo a Richard Dawkins. La teoría de la arcilla postula que las moléculas orgánicas complejas crecieron gradualmente en una plataforma de replicación no orgánica preexistente —cristales de silicato en disolución—. La complejidad de las moléculas acompañantes que se desarrollaba como una función de las presiones de selección en tipos de cristales de arcilla es entonces extraída para servir a la replicación de moléculas orgánicas independientemente de su «pista de despegue» en su silicato. Cairns-Smith es un firme crítico de otros modelos de evolución química.[110] No obstante, él admite que, como muchos modelos del origen de la vida, el suyo también tiene defectos (Horgan 1991). Es verdaderamente, «sacar la vida de debajo de las piedras». Peggy Rigou del Instituto Nacional de Investigación Agronómica de EE. UU. (INRA), en Jouy-en-Josas, Francia, publicó en la edición del 11 de febrero de Science News que los priones son capaces de unirse a partículas de arcilla y abandonar estas partículas cuando la arcilla se carga negativamente. Aunque no se hace ninguna referencia en el apartado de implicaciones para las teorías del origen de la vida, esta investigación podría sugerir que los priones son una ruta probable hacia las primeras moléculas reproductoras. En 2007, Kahr y colaboradores publicaron sus experimentos que examinan la idea de que los cristales pueden actuar como una fuente de información transferible, usando cristales de ftalato de potasio hidrogenado. Los cristales «madre» con imperfecciones fueron cortados y usados como semillas para criar cristales «hijos» a partir de la disolución. Entonces examinaron la distribución de las imperfecciones en el sistema cristalino y encontraron que las imperfecciones de los cristales madre realmente se reproducían en los hijos. Los cristales hijos tenían muchas imperfecciones adicionales. Para una conducta paragenética las imperfecciones adicionales deberían ser mucho menores que las de los padres, y de ahí que Kahr concluya que los cristales «no eran lo suficientemente fieles como para almacenar información de una generación a la siguiente».[111][112] El mundo de lípidosHay una teoría que afirma que las primeras sustancias autorreplicantes eran de tipo lipídico.[113] Se sabe que los fosfolípidos forman bicapas en el agua si están sometidas a agitación. Esta estructura es idéntica a la de las membranas celulares. Estas moléculas no se encontraban en la tierra primigenia, aunque otras cadenas anfifílicas largas también forman membranas. Además, estos cuerpos se pueden expandir por inserción de lípidos adicionales, y bajo una expansión excesiva pueden sufrir escisiones espontáneas que conservan el mismo tamaño y composición de lípidos en ambas progenies. La idea principal de esta teoría es que la composición molecular de los cuerpos lipídicos es la primera forma de almacenar información y la evolución conduce a la aparición de entidades poliméricas como el ARN o el ADN que pueden almacenar información favorablemente. Aún no se ha hablado de ningún mecanismo que apoye la teoría del mundo de lípidos. El mundo de zincLa teoría del mundo de zinc propone que los fluidos hidrotermales ricos en H2 S que interactúan con el agua fría del océano primordial conducen a la precipitación de partículas de sulfuro metálico. Sistemas de ventilación oceánicos y otros sistemas hidrotermales tienen una estructura zonal reflejada en antiguos depósitos volcanogénicos de sulfuros masivos (VMS) de origen hidrotermal. Los más abundantes son pirita (FeS 2), calcopirita (CuFeS 2) y esfalerita (ZnS), con adiciones de galena (PbS) y alabandita (MnS), ZnS y MnS tienen una capacidad única para almacenar energía de radiación, por ejemplo, de luz ultravioleta. Durante la ventana de tiempo relevante de los orígenes de las moléculas en replicación, la presión atmosférica primordial era lo suficientemente alta (> 100 bar, alrededor de 100 atmósferas) para precipitar cerca de la superficie de la Tierra, y la irradiación ultravioleta era de 10 a 100 veces más intensa que ahora; por lo tanto, las propiedades fotosintéticas únicas mediadas por ZnS proporcionaron las condiciones energéticas adecuadas para activar la síntesis de moléculas informativas y metabólicas y la selección de nucleobases fotoestables.[114] La teoría del mundo de zinc se ha completado con evidencia experimental y teórica de la constitución iónica del interior de los primeros protobiontes antes de que evolucionaran a células. Archibald Macallum notó la semejanza de los fluidos corporales como la sangre y la linfa con el agua de mar; Sin embargo, la composición inorgánica de todas las células difiere de la del agua de mar moderna, lo que llevó a Mulkidjanian y sus colegas a reconstruir los "criaderos" de las primeras células combinando análisis geoquímico con filogenómico de los requisitos de iones inorgánicos de los componentes universales de las células modernas. Los autores concluyen que las proteínas y los sistemas funcionales ubicuos y primordiales por inferencia muestran afinidad y requisitos funcionales para K + , Zn 2+ , Mn 2+ y [PO4]. La reconstrucción geoquímica muestra que la composición iónica que conduce al origen de las células no podría haber existido en lo que hoy llamamos entornos marinos, pero es compatible con las emisiones de zonas dominadas por vapor de lo que hoy llamamos sistemas geotérmicos continentales. Bajo la atmósfera primordial empobrecida en oxígeno y dominada por CO 2 , la química de los condensados de agua y las exhalaciones cerca de los campos geotérmicos se asemejaría al medio interno de las células modernas. Por lo tanto, las etapas precelulares de evolución pueden haber tenido lugar en el océano primordial poco profundos revestidos con minerales de silicato poroso mezclados con sulfuros metálicos y enriquecidos en compuestos de K + , Zn 2+ y fósforo.[115] Hipótesis del mundo de HAP Se han postulado otras fuentes de moléculas complejas, incluyendo algunas de origen extraterrestre, estelar o interestelar. Por ejemplo, se sabe a partir de análisis espectrales y directos que las moléculas orgánicas están presentes en cometas y meteoritos. En 2004, un equipo de investigación detectó trazas de hidrocarburos aromáticos policíclicos (HAPs) en una nebulosa.[116] Éstas son las moléculas más complejas encontradas en el espacio hasta el momento. El uso de los HAP ha sido también propuesto como precursor del mundo de ARN en la hipótesis del mundo de HAP.[117] El Telescopio espacial Spitzer ha detectado recientemente una estrella, la HH 46-IR, que está formándose en un proceso similar al del Sol. En el disco de material que rodea la estrella hay una gran variedad de moléculas que incluyen los compuestos de cianuro, hidrocarburos e hidróxido de carbono. También se han encontrado HAPs por toda la superficie de la galaxia M81, que está a 12 millones de años luz de la Tierra, confirmando su amplia distribución en el espacio.[118] El acervo genético primordialSe ha sugerido que las hipotéticas moléculas autorreplicantes del mundo de ARN estuvieron conformadas por los elementos genómicos o secuencias de las células como los ribosomas, ribozimas, intrones, retrones, transposones, plásmidos, exones, enzimas, etc a la par de los virus, viroides, virusoides y virus satélite. Estas moléculas o entidades acelulares se les conoce comúnmente como "replicadores" o "replicones". El conjunto de replicadores o elementos genéticos que pudo conformar el mundo de ARN y sus transiciones se le llama el "acervo genético primordial".[119][120][121][122] Los virus, viroides, virusoides y virus satélite son agentes infecciosos acelulares que no son considerados seres vivos porque no cumplen muchas de las funciones que definen la vida. Se han relacionado con la evolución de los organismos celulares, ya que su simplicidad y estrategias de replicación diferentes pueden considerarse claves para entender la transición entre células y moléculas orgánicas. Según análisis de las proteínas virales y las estrategias de replicación de los virus, estos se originaron realmente antes que el último antepasado común universal (LUCA).[119] Theodor Diener propone que los viroides y virusoides (agentes subvirales compuestos por ARN sin proteínas y lípidos), en función de sus propiedades características, los viroides y virusoides son "reliquias vivas" más plausibles del mundo de ARN que los intrones u otros ARN que hasta entonces se consideraban como posibles modelos[123] debido a que presentan características primordiales como la actividad catalítica, replicación prospensa a errores, estructura circular del ARN que asegura una replicación completa sin etiquetas genómicas, falta de codificación de proteínas y transcripción de ADN, replicación mediada por ribozimas, la huella digital del mundo de ARN.[124] Esto sostiene que dichas características pudieron haber estado presentes en las primeras moléculas autorreplicantes del mundo de ARN. Los virus de ARN también pueden considerarse reliquias puesto que su replicación se basa únicamente en el ARN y podrían estar relacionados con la primera codificación de proteínas. Algunos virus de ADN bicatenario (principalmente bacteriófagos) tienen uracilo en su ADN denominado ADN-U, el uracilo es considerado un nucleótido típico del ARN. Este tipo de ADN está ausente en las células, por lo que dichos virus podrían representar una reliquia de la transición del ARN al ADN.[121][120]  Con base en estos descubrimientos Eugene Koonin (2006, 2014, 2020) y Patrick Forterre (2005, 2006) proponen que los virus, viroides y virus satélite pudieron mediar las transiciones del mundo de ARN junto con los otros replicadores. Estas transiciones del mundo de ARN se les ha nombrado, mundo de ARN verdadero (la etapa inicial), mundo de ARN + proteínas, mundo de retrotranscripción y mundo de ADN (la etapa final). Se ha propuesto que los viroides, virusoides junto con los ribozimas e intrones del grupo I fueron los primeros replicadores de la etapa inicial del mundo de ARN debido a que no codifican proteínas, y porque los viroides y virusoides tampoco transcriben ADN, estos replicadores al haberse unido con proteínas, darían paso al mundo de ARN + proteínas donde comenzaría la codificación de proteínas sin transcripción de ADN y surgirían los virus de ARN, satélites de ARN y la ARN polimerasa dependiente de ARN que codifican proteínas sin transcripción de ADN, posteriormente estos precederían a los retroelementos como los intrones del grupo II, retrones, exones, la transcriptasa inversa y elementos de ARN dependientes de ADN como los ribosomas, las ARN polimerasas dependientes de ADN, dando paso al mundo de retrotranscripción y el comienzo de la transcripción de ADN, a su vez estos elementos harían la transición del ARN al ADN pasando finalmente al mundo de ADN donde por último se originarían las ADN polimerasas, virus de ADN, satélites de ADN, los cromosomas, transposones, plásmidos, repeticiones en tándem, etc. Estos acelulares o elementos genéticos al haber estado contenidos en membranas lipídicas o protobiontes originarían a las primeras células.[119][121][122][120][125][126][127] Un experimento (2015) ha demostrado que las cápsides de los virus pudieron haberse originado en el mundo de ARN y servían como un medio de transferencia horizontal entre las comunidades de replicadores de los protobiontes dado que estas comunidades no podrían sobrevivir si el número de parásitos génicos aumentaba, siendo ciertos genes los responsables de la formación de estas estructuras y los que favorecían la supervivencia de las comunidades autorreplicativas.[128] El desplazamiento de estos genes entre los organismos celulares pudieron favorecer la aparición de nuevos virus durante la evolución.[119] AutocatálisisEl biólogo evolutivo británico Richard Dawkins escribió sobre la autocatálisis como una explicación potencial para el origen de la vida en su libro La historia del antepasado (2004). Los autocatalizadores son substancias que catalizan su propia producción y tienen por tanto la propiedad de ser un replicador molecular simple. En este libro, Dawkins cita experimentos llevados a cabo por Julius Rebek y colaboradores en el Sripps Research Institute de California en el que combinan aminoadenosina y éster de pentafluorofenilo con el autocatalizador éster triácido de aminoadenosina (AATE). Un sistema del experimento contenía variantes de AATE que catalizaban su propia síntesis. Este experimento demostraba la posibilidad de que la autocatálisis podía mostrar competición entre una población de entidades con herencia, que podía ser interpretada como una forma rudimentaria de selección natural. Modelo de Gold de «Biosfera profunda y caliente»El descubrimiento de los nanobios (estructuras filamentosas más pequeñas que las bacterias que contienen ADN) en rocas profundas, llevó a una teoría controvertida presentada por Thomas Gold a principios de los años 1990 en la que se exponía que la vida se desarrolló al principio no en la superficie de la Tierra, sino varios kilómetros bajo la superficie. Ahora se sabe que la vida microbiana es abundante a más de cinco kilómetros bajo la superficie de la Tierra en forma de arqueobacterias, que se considera que se originaron o antes o aproximadamente al mismo tiempo que las eucariotass, muchas de las cuales viven en la superficie (incluyendo los océanos). Se ha afirmado que el descubrimiento de vida microbiana bajo la superficie de otro cuerpo del Sistema Solar daría un crédito significativo a esta teoría. También decía que un suministro de nutrientes de una fuente profunda e inalcanzable promovería la supervivencia porque la vida que surge en un montón de materia orgánica probablemente consumiría todo su alimento y acabaría extinguiéndose. El modelo del polifosfatoEl problema con muchos de los modelos de abiogénesis es que el equilibrio termodinámico favorece a los aminoácidos dispersos antes que a sus polímeros, los polipéptidos; es decir, que la polimerización es endotérmica. Lo que hace falta es una causa que promueva la polimerización. Una solución al problema puede encontrarse en las propiedades de los polifosfatos.[129][130] Los polifosfatos se forman por la polimerización de los iones ordinarios de monofosfato (PO4-3) bajo la acción de la radiación ultravioleta. Los polifosfatos pueden catalizar la polimerización de los aminoácidos a polipéptidos, reduciendo la barrera de energía y haciendo así factible el proceso. En los meteoritos metálicos es relativamente abundante el fosfuro de hierro y níquel (schreibersita), el cual, en contacto con el agua, libera iones fosfato y fosfito solubles y muy reactivos.[cita requerida] La teoría termodinámica disipativa del origen de la vidaEl sintetizar todas las moléculas de la vida no es suficiente para darle a esta la vitalidad necesaria a fin de autorreplicarse y evolucionar. Miles de experimentos sobre los 64 años desde los primeros experimentos de Miller han fallado en su intento de crear la vitalidad de la vida como la conocemos. El hecho no considerado con seriedad en investigaciones anteriores es que la vida resulta un proceso, no un objeto o una simple distribución de moléculas en equilibrio. La vida, como cualquier proceso irreversible macroscópico, requiere la consideración del potencial químico generalizado impuesto que, al tiempo que es disipado por la vida misma, sirve también como motor para ella y su evolución. La producción de entropía debido a esta disipación debe de ser, entonces, el elemento fundamental en cualquier intento de entender el origen de la vida a nivel físico-químico. Las estructuras disipativas resultan de la tendencia de la naturaleza a aumentar la producción de entropía global a causa de la disipación de un potencial químico generalizado.[131] Son sistemas termodinámicamente abiertos, su existencia es dependiente de intercambios de energía y materia con su ambiente. Ejemplos son los huracanes, las corrientes de aire o agua, las celdas de convección y la vida misma. Una nueva teoría sobre el origen de la vida propuesto por Karo Michaelian de la Universidad Nacional Autónoma de México (UNAM) que fue elaborada sobre una base de la termodinámica irreversible que considera la producción de entropía como caracteristics fundamental y conocido como “la teoría termodinámica disipativa del origen de la vida”.[132][133][134] En particular, la teoría analiza lo que pasa con la energía de los fotones que la Tierra recibía del Sol (un potencial químico generalizado) en los tiempos que se cree surgió la vida, y el regreso de esta energía al espacio en forma degradada (“degradada” porque después de interactuar con los primeros seres vivos sobre la Tierra, la luz no regresaba al espacio con las mismas características con las que llegó, sino en forma de fotones de menor energía). Todos estos procesos, desde la absorción y disipación de fotones en materia orgánica, hasta el ciclo del agua, cambiaría el espectro de la energía emitida por la Tierra, llevándolo hacia el infrarrojo, es decir, más fotones de menor energía cada uno.[19] En otras palabras, la materia orgánica ha logrado repartir la energía que llega del Sol sobre más grados de libertad microscópicos. La teoría se basa, principalmente, en dos conceptos: la absorción y disipación de fotones en el UV por ADN y ARN debido a sus propiedades ópticas y físicas, y el concepto de la producción de entropía en este disipación en relación con el origen, proliferación y evolución de las moléculas fundamentales de la vida.[18] Actualmente en la superficie de los mares se encuentran flotando gran cantidad de materia orgánica, microorganismos como las cianobacterias y las diatomeas, además de virus y muchas cadenas de ARN y ADN libres, así como otros compuestos orgánicos.[135] Todo este conjunto de microorganismos y moléculas absorben parte de la luz que llega del Sol y la convierten en calor que es transmitido al agua.[136] De haber solo agua en los mares, en su superficie absorbería nada más la luz infrarroja que llega del Sol porque el agua solo absorbe fuertemente en ese rango. Pero la existencia de dichos microorganismos y moléculas orgánicas permite no solo absorber en el infrarrojo sino también en el espectro visible y en el ultravioleta. Entonces la vida quita una restricción a la que se puede llamar “sólo absorber en el infrarrojo” para dar lugar a la absorción y disipación de luz en un rango mucho más amplio, y de hecho, en un rango donde nuestro Sol es más intenso. El calor transmitido al agua por estas moléculas provoca la evaporación de ésta en la superficie de los mares; la evaporación genera nubes que viajan y hacen llover en tierra firme. Ya en tierra firme el agua, así como otros minerales, permite el crecimiento de plantas terrestres que también absorben la luz del Sol por medio de sus pigmentos orgánicos como la clorofila y el caroteno.[137] Así, la absorción de la luz solar por medio de moléculas orgánicas promueve el ciclo del agua y el ciclo del agua a su vez da más posibilidades de generar más vida. A esta conjunto de procesos se les llama “procesos termodinámicos irreversibles acoplados”. El acoplamiento de la disipación de luz por moléculas orgánicas en la superficie de la Tierra con el ciclo de agua produce más del 63% de toda la entropía generada por la interacción fotónica Sol-Tierra.[19] Dado que la disipación de fotones es el trabajo termodinámico más relevante que lleva a cabo la vida actualmente, es probable que también ésta haya sido su función hace 3.8 mil millones de años, fecha para el cual hay evidencias de que se originó.[138] Por falta de oxígeno y ozono, la atmósfera terrestre de ese entonces permitía el paso libre de la luz con longitudes de onda de entre 220 y 280 nanómetros (nm), o sea la radiación ultravioleta, y al mismo tiempo no permitía que la luz visible (de entre 400 y 700 nm) pasara con facilidad.[139] El Sol joven emitía radiación UV con una intensidad hasta diez veces mayor que el Sol actual. Es concebible, entonces, que la vida haya empezado disipando fotones en el UV y más tarde, mientras la atmósfera permitía pasar cada vez más la luz visible, haya desarrollado pigmentos que absorbieran y disiparan en el espectro visible, donde la luz incidente del Sol era más intensa.[140] Se sabe que cuando el ARN y el ADN están en agua absorben y disipan eficientemente los fotones de luz UV con una longitud de onda alrededor de 260 nm,[141] justamente dentro del intervalo en el que la atmósfera era transparente en el Arqueano[139] (la etapa geológica que comenzó hace 3 800 millones de años y finalizó hace 2 500 millones de años). Esta propiedad se debe a que, expuestos a la luz UV, las bases de ARN y ADN (adenina, guanina, citosina y timina o uracilo según se trate de ADN o ARN) se excitan electrónicamente (excitación de los electrones en sus anillos aromáticos) y decaen rápidamente por una intersección cónica mediante conversión interna, convirtiendo en calor la energía del fotón absorbido. Es justamente esta propiedad disipativa de la luz la que trae como consecuencia, según la teoría propuesta, la proliferación de bases nucleicas sobre la superficie de la Tierra y la reproducción de las cadenas de ADN y ARN. El modelo de la ecopoiesisEl modelo de la ecopoiesis ha sido desarrollado por los científicos brasileños Félix de Sousa y Rodrigues Lima.[142] Es un modelo que integra elementos y observaciones de varios otros. En esta teoría es el ambiente físico (Οικος) el que promueve la aparición de la vida en los estadios tempranos en lugar de hacerlo la aparición al azar de organismos que posteriormente condicionan el entorno, en especial, en cuanto a la acumulación de oxígeno. Propone que los ciclos geoquímicos de los elementos biogénicos, dirigidos por una atmósfera primordial rica en oxígeno procedente de la fotólisis del vapor de agua evaporado de los océanos e hipercarbónica, pudieron ser la base de un metabolismo planetario de carácter espacialmente continuo y global, que habría precedido y condicionado la aparición gradual de una vida como la actual, organizada en organismos discontinuos (individualizados). Algunas de sus predicciones serían las siguientes:
Exogénesis: vida primitiva extraterrestreOtra alternativa a la abiogénesis terrícola es la hipótesis de que la vida primitiva pudo haberse formado originalmente fuera de la Tierra (adviértase que exogénesis está relacionado, pero no es lo mismo que la noción de panspermia). Se supone que una lluvia de material procedente de cometas que se precipitó sobre la Tierra primitiva pudo haber traído cantidades significativas de moléculas orgánicas complejas y, quizás, la misma vida primitiva formada en el espacio fue traída a la Tierra por material cometario o asteroides de otros sistemas estelares. Los componentes orgánicos son relativamente comunes en el espacio, especialmente en el sistema solar exterior, donde las sustancias volátiles no son evaporadas por el calentamiento solar. En los cometas se encuentran incrustaciones de capas externas de material oscuro que, se piensa, son sustancias bituminosas compuestas por material orgánico complejo formado por compuestos de carbono simples tras reacciones iniciadas mayormente por irradiación por luz ultravioleta. 2002, también se detectó el aminoácido más simple, la glicina. En 2023 se descubrió en un experimento de laboratorio una posible vía abiótica para la formación de cadenas peptídicas a partir de aminoácidos. Pequeños grupos de moléculas de glicina muestran polimerización tras la aportación de energía incluso sin un sustrato catalítico sólido, lo que es un indicio de la posible formación de cadenas de aminoácidos en las condiciones extremas del espacio.[143] Una hipótesis relacionada con ésta es que la vida se formó en primer lugar en el Marte primigenio y fue transportada a la Tierra cuando material de su corteza fue expulsada de Marte por un asteroide e impactos cometarios para más tarde alcanzar la Tierra. Es difícil encontrar evidencias para ambas hipótesis y puede que haya que esperar a que se traigan muestras de cometas y de Marte para su estudio. Ninguna de ellas responde realmente a la cuestión de cómo se originó por primera vez la vida, sino que meramente traslada este origen a otro planeta o cometa. No obstante, esta hipótesis extiende tremendamente el abanico de condiciones bajo el cual se pudo haber formado la vida, desde las posibles condiciones primitivas de la Tierra a literalmente las condiciones de todo el Universo. Teoría de la panspermia La ventaja de las hipótesis de un origen extraterrestre de la vida primitiva es que incrementa el campo de probabilidad para que la vida se desarrolle. No se requiere que se desarrolle en cada planeta en el cual se halle, sino más bien en una sola localización y posteriormente se extiende por la galaxia hacia otros sistemas estelares a través del material cometario. Esta idea ha recibido impulsos debido a los descubrimientos sobre microbios muy resistentes.[144] Una alternativa a la abiogénesis terrestre es la hipótesis de la panspermia, que sugiere que las «semillas» o la esencia de la vida prevalecen diseminadas por todo el Universo y que la vida comenzó en la Tierra gracias a la llegada de tales semillas a nuestro planeta. Estas ideas tienen su origen en algunas de las consideraciones del filósofo griego Anaxágoras. El astrónomo Sir Fred Hoyle también apoyó la idea de la panspermia. Se basa en la comprobación de que ciertos organismos terrestres (ciertas bacterias, cianobacterias y líquenes) son tremendamente resistentes a condiciones adversas y que finalmente pueden viajar por el espacio y colonizar otros planetas.[145] Hipótesis de la génesis múltipleSe habría dado la aparición de diferentes formas de vida casi simultáneamente en la historia temprana de la Tierra,[146] dado que parece existir un único antepasado común entre todos los seres vivos, las otras formas estarían extintas, dejándonos fósiles a través de su diferente bioquímica. Por ejemplo, por el uso de otros elementos, como el arsénico en lugar del fósforo, y sobreviviendo como extremófilas o simplemente permaneciendo ignoradas al ser análogas a los organismos del actual árbol de la vida. Hartman, por ejemplo, combina algunas teorías proponiendo lo siguiente:[147]
Véase también
NotasReferencias
Enlaces externosEspañol:
Inglés:
|