|
Squalen-Monooxygenase
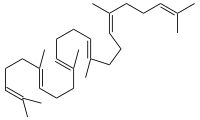
Die Squalen-Monooxygenase (Squalenepoxidase, SE) ist das Enzym, das die Oxidation von Squalen zu S-Squalen-2,3-epoxid katalysiert. Diese Reaktion findet in Eukaryoten und manchen Bakterien statt; in Tieren ist sie Teil der Cholesterinbiosynthese. Im Mensch ist SE in den Mikrosomen lokalisiert.[1][2][3] Die „-fin“ Antimykotika, wie Terbinafin oder Amorolfin, hemmen die Squalenepoxidase und finden Anwendung z. B. bei der Bekämpfung von Nagelpilz. Katalysierte ReaktionSqualen wird zu (S)-Squalen-2,3-epoxid oxidiert, der Acceptor wird dehydriert. WeblinksWikibooks: Biochemie und Pathobiochemie: Cholesterinbiosynthese – Lern- und Lehrmaterialien
Einzelnachweise
|
|||||||||||||||||||||||||||||||||||||||||||||