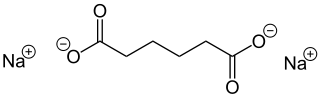
Natriumadipat ist eine chemische Verbindung aus der Gruppe der Carbonsäuresalze und das Natriumsalz der Adipinsäure.
Herstellung
Natriumadipat kann durch Reaktion von Adipinsäure mit Natriumcarbonat hergestellt werden.[3]

Auch die Neutralisation von Natronlauge mit einer ethanolischen Lösung von Adipinsäure liefert Natriumadipat.[4]

Eigenschaften
Natriumadipat ist ein farbloser Feststoff, welcher leicht löslich in Wasser ist.[2][5] Es kristallisiert als Hemihydrat in glänzenden, leicht hygroskopischen Blättchen.[3]
Die Lösungsenthalpie von Natriumadipat bei 298,15 K beträgt 15,70 kJ·mol−1.[6]
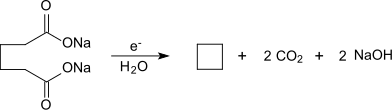
Bei der Elektrolyse einer wässrigen Lösung von Natriumadipat entsteht Cyclobutan.[7]
Verwendung
Natriumadipat wird als Lebensmittelzusatzstoff als Säuerungsmittel, Säureregulator und Kochsalzersatz eingesetzt.[8] Daneben findet es Anwendung als Stabilisator von PVC.[5] Durch Fällung einer heißen Bariumchloridlösung mit Natriumadipat kann Bariumadipat hergestellt werden.[3]

Einzelnachweise
- ↑ Eintrag zu E 356: Sodium adipate in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 28. Juni 2020.
- ↑ a b c d Eintrag zu Dinatriumadipat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Mai 2017. (JavaScript erforderlich)
- ↑ a b c d W. Dieterle, C. Hell: Zur Kenntnis der Adipinsäure. In: Ber. d. dt. chem. Ges. Band 17, 1884, S. 2221–2228 (Digitalisat auf Gallica).
- ↑ M. Vera, L. Franco, J. Puiggalí: Synthesis of poly(ester amide)s with lateral groups from a bulk polycondensation reaction with formation of sodium chloride salts. In: Journal of Polymer Science A: Polymer Chemistry 2008, 46(2), S. 661–667. doi:10.1002/pola.22414
- ↑ a b Quelle: @1@2Vorlage:Toter Link/www.mckinn.com.sgPRODUCT SPECIFICATION Sodium Adipate (Seite dauerhaft nicht mehr abrufbar, festgestellt im Oktober 2017. Suche in Webarchiven)
- ↑ M. Z. H. Rozaini, P. Brimblecombe: The solubility measurements of sodium dicarboxylate salts; sodium oxalate, malonate, succinate, glutarate, and adipate in water from T = (279.15 to 358.15) K. In: The Journal of Chemical Thermodynamics 2009, 41(9), S. 980–983. doi:10.1016/j.jct.2009.03.017
- ↑ Rachna Sagar: Together with Aieee Chemistry, Verlag Rachna Sagar, ISBN 978-81-8137-365-6, S. 481 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Peter Kuhnert: Lexikon Lebensmittelzusatzstoffe: Zusatzstoffe, Enzyme, technische Hilfsstoffe, Nahrungsergänzungsstoffe. Behr’s, 2014, ISBN 978-3-95468-000-9, S. 17 (eingeschränkte Vorschau in der Google-Buchsuche).