|
Cajal-Körper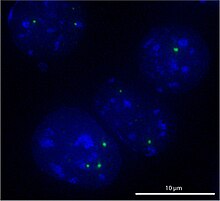 Cajal-Körper („Cajal Bodies“ (CBs), „Coiled Bodies“) sind sphärische Sub-Organellen innerhalb des Zellkerns, die in sich schnell vermehrenden Zellen wie solchen in Embryonen oder Tumorzellen auftreten. Im Gegensatz zu Organellen des Cytoplasmas haben Cajal-Körper keine Membran, um ihren Inhalt von dem umgebenden Karyoplasma zu trennen. Sie enthalten Komponenten der RNA-Prozessierung, ihre genaue Funktion ist Gegenstand aktueller Forschung. Sie haben einen Durchmesser von 0,3–1,0 µm und bestehen aus RNA und Proteinen. In den Zellkernen von Säugetier-, Pflanzen- und Drosophila-Zellen kommen im Schnitt nur ein bis zwei dieser Körper vor, während in den Keimbläschen beim Krallenfrosch bis zu 100 CBs auftreten.[1] Sie sind beteiligt an der Herstellung unterschiedlicher Arten von snRNPs, dies sind kleine nukleäre Ribonukleoproteinpartikel. Die Cajal-Körper werden mit einbezogen in RNA-Stoffwechselprozesse wie die Herstellung, Reifung und Abbau von snRNPs, Prozessierung histonischer mRNA und der Erhaltung von Telomeren.[2] Der bekannteste dieser Prozesse ist die Modifikation und Montage von U-snRNPs, von denen einige schließlich das Spleißosom bilden. Cajal-Körper sind im Laufe der Evolution weitgehend unverändert geblieben.[1] Entdeckt wurden sie zuerst von Santiago Ramón y Cajal im Jahr 1903, der sie aufgrund ihrer Assoziation mit den Zellkernen in neuronalen Zellen „nukleäre Hilfskörper“ nannte. Sie wurden später mit Elektronenmikroskopen wiederentdeckt und hier aufgrund ihrer Form als „Coiled Bodies“ benannt. Erst später wurden sie nach ihrem Entdecker bezeichnet. Die Forschung an den Cajal-Körpern beschleunigte sich, als man entdeckte, dass man das Protein p80/Coilin als Marker für diese Körper einsetzen konnte. Die Wechselwirkung von Coilin mit anderen Proteinen scheint die Effizienz von mehreren Kernprozessen durch Konzentration ihrer Komponenten im Cajal-Körper zu verbessern.[3] Geschichte1903 entdeckte Ramón y Cajal in einer Vielzahl von Neuronen und in mehreren Säugetierarten (Kaninchen, Hund und Mensch) eine scharf definierte argyrophile (silberaffine) Struktur mit einem Durchmesser von ca. 0,5 µm, die eine homogene Textur hatte und frei im Karyoplasma zu bestehen schien. Im selben Jahr veröffentlichte Ramón y Cajal seine Silbernitratmethode mit mehreren Varianten, die es ihm ermöglichte, verschiedene intrazelluläre Strukturen – im Wesentlichen nukleäre Komponenten und Neurofibrillen (Neurofilamente) – aufgrund ihrer ausgeprägten Silberaffinität klar zu charakterisieren. Sieben Jahre später publizierte er einen ausführlichen Artikel über den Aufbau des Zellkerns in Neuronen von Säugetieren (El núcleo de las células piramidales del cerebro humano y de algunos mamíferos). In diesem Artikel berichtete Ramón y Cajal über das Vorhandensein einer neuen Kernstruktur in Säuger-Neuronen, dem „Hilfskörper“, sowie über erste vorläufige Daten zur Struktur und Organisation des Zellkerns in mehreren neuronalen Typen. Nach ihrer Charakterisierung durch Ramón y Cajal erregten die „Hilfskörper“ bis in die 1950er Jahre wenig Aufmerksamkeit, bis Murray Barr von der University of Western Ontario und sein Team ihr Interesse auf die Organisation des neuronalen Kerns konzentrierten. Sie veröffentlichten mehrere Arbeiten. Dabei bestätigten sie Ramón y Cajals Beobachtungen, führten eine quantitative Analyse der Häufigkeit der Hilfskörper in mehreren Nervenzentren durch und berichteten über das seltene Auftreten einer argyrophilen paranuklearen Struktur in Katzenneuronen. 1969 führten Monneron und Bernhard eine Studie über die Kernorganisation mehrerer Säugetierzelltypen durch. Neben anderen RNA-reichen Kernstrukturen berichteten sie über eine neue nukleäre Komponente, die sie als „Coiled Bodies“ bezeichneten. Weitere unterschiedliche Bezeichnungen waren „Binnenkörper“ in Insekten (Bier et al. 1967) und Nukleolus-assoziierte Körper in Pflanzen (Chamberland und Lafontaine 1993). Im Jahr 1999 erschienen zwei Veröffentlichungen von Carvalho und Gall, welche die Nomenklatur „Cajal body“ einführten.[4] Beteiligte ProteinesnRNPssnRNPs sind makromolekulare Komplexe, die für die Genexpression benötigt werden. snRNPs lagern sich u. a. zusammen zu einem Spleißosom, welches dazu dient, Introns aus einer neu erzeugten RNA herauszuschneiden. Forscher haben schnell erkannt, dass Cajal-Körper eine Vielzahl von Proteinen und RNAs enthalten, die an der RNA-Verarbeitung beteiligt sind, insbesondere die zum Spleißen notwendigen snRNAs (U1, U2, U4, U5 und U6) und die damit verbundenen Proteine.[5] Cajal-Körper in Zellkulturen sind empfindlich gegenüber der Hemmung von Transkription, Spleißen und snRNP-Biogenese. Hierbei verschwinden zuerst die snRNPs nach Transkription und Spleißhemmung aus den CBs, gefolgt von der Auflösung des Cajal-Körpers kurz darauf. Dies zeigt, dass die ständige Produktion und das Recycling von snRNPs für die Integrität der Cajal-Körper unerlässlich sind.[2] In allen Spezies, die bis heute erforscht wurden, sind die spleißosomalen snRNPs in den Cajal-Körpern gebündelt.[1] Survival of motor neuron – SMNWie der Name andeutet, ist SMN bei Säugetieren Voraussetzung für die Funktion von Motoneuronen, insbesondere des Rückenmarks. Mutationen des Gens dieses Proteins können zu einer spinalen Muskelatrophie führen. Biochemische Studien zeigen, dass SMN in Wirbeltierzellen in einem makromolekularen Komplex auftritt, der aus SMN selbst und mehreren anderen Faktoren besteht. Dieser Komplex fungiert im Cytoplasma als Chaperon für die Montage der snRNAs mit dem siebengliedrigen Ring aus Sm-Proteinen. SMN begleitet die neu hergestellten snRNPs bei ihrer Rückkehr in den Kern, aber ob SMN eine spezifische Funktion im Cajal-Körper hat, ist nicht bekannt.[5] CoilinDas Coilin-Protein ist eine der wichtigsten molekularen Komponenten von Cajal-Körpern. Nach seiner Entdeckung in HeLa-Zellen wurde Coilin schnell zum Marker für CBs in Säugerzellen. Trotz seiner Nützlichkeit als Marker für Cajal-Körper ist relativ wenig über Coilin als Protein bekannt, insbesondere welche biochemischen Funktionen es darin haben könnte.[5] Die Coilin-Proteine von Mensch und Maus sind ähnlich groß, 62,6 kDa bzw. 62,3 kDa. Coilin bindet an das Survival-Motor-Neuron-Protein (SMN) und an verschiedene Sm- und Lsm-Proteine, was darauf hindeutet, dass es zur Montage oder Modifikation von snRNPs beiträgt. Es scheint, dass Coilin (und die Verbindung von Cajal-Körpern) den Verbund von snRNPs begünstigt, entweder durch die Förderung des finalen Reifeprozesses der snRNPs oder dadurch, dass Wechselbeziehungen zwischen individuellen snRNPs zur Bildung übergeordneter Komplexe ermöglicht werden.[1] Coilin scheint für die Integrität und Funktion des Cajal-Körpers unerlässlich zu sein. In Abwesenheit von CBs laufen die gleichen Reaktionen mit geringerer Effizienz im Karyoplasma ab. Dies steht im Einklang mit der Ansicht des Cajal-Körpers als Mittel zur Steigerung der Effizienz der snRNP-Anordnung durch die Konzentration von Enzymen und Substraten in einer Region des Karyoplasmas. So ist in den drei Organismen, in denen Coilin-Mutationen untersucht wurden, Coilin für die normale CB-Bildung erforderlich, aber weder Coilin noch ein typisches CB sind für die Lebensfähigkeit wesentlich.[3] Zusätzlich zu seiner strukturellen Rolle fungiert Coilin als Klebstoff, um die Cajal-Körper mit dem Nukleolus zu verbinden. Ablauf der Herstellung von snRNPsÜbersicht Während der Biogenese von snRNAs zu gereiften snRNPs müssen die snRNAs ins Cytoplasma und die erstellten snRNPs dann zurück in den Zellkern transportiert werden. 1) Zuerst wird aus der DNA die snRNA mithilfe des RNA-Polymerase-II-Moleküls transkribiert. 2) Nun werden an die snRNA weitere Moleküle angelagert, die als Transportsignal dienen. Hierdurch wird das snRNA-Molekül durch eine Kernpore in das Cytoplasma exportiert. 3) Im Cytoplasma binden sich Sm-Proteine mit dem SMN-Protein-Komplex an die snRNAs. (Sm/LSm-Proteine werden durch eine Anordnung in Ringen von sechs oder sieben einzelnen LSm-Proteinmolekülen definiert und spielen eine Vielzahl verschiedener Rollen bei der mRNA-Verarbeitung und -Regulierung.) Zudem wird die snRNA durch weitere Enzyme modifiziert. Hierbei wird der Kern des snRNP-Moleküls gebildet. 4) Das snRNP wird über eine Kernpore wieder in den Zellkern transportiert. 5) Im Zellkern finden weitere Modifikationen des snRNP-Moleküls im Cajal-Körper statt. Hier werden z. B. weitere spezifische Proteine hinzugefügt. Nach der endgültigen Reifung des snRNPs wird das Molekül für den Spleißprozess eingesetzt. Prozesse innerhalb des Cajal-Körpers Sowohl große als auch kleine U-snRNA-Gene finden sich oft in der Nähe von nukleären Cajal-Körpern. Mehrere Studien haben gezeigt, dass snRNA-Transkription und die dabei entstehenden snRNAs für die Assoziation von CBs mit dem U-snRNA-Gen notwendig sind. Es wurde vorgeschlagen, dass CBs an der Organisation von snRNA-Genen im Zellkern beteiligt sind. snRNAs sind vielleicht bereits ab ihrer Bildung mit den CBs verbunden. Das Fehlen von Proteinen, die für die Integrität von CBs essentiell sind, führt zu einer geringeren Expression aller snRNAs. Wie genau CBs die snRNA-Expression verbessern, ist derzeit unklar.[2] Aus der Tatsache, dass Coilin direkt mit snRNAs assoziiert ist und sogar eine direkte Rolle bei deren Verarbeitung spielen könnte, kann man schließen, dass CBs an der 3'-Endverarbeitung von pre-snRNAs beteiligt sind. Nach der Spaltung an deren 3'-Ende werden snRNAs über einen Komplex in das Cytoplasma exportiert (1). Dieser enthält unter anderem die Proteine XPO1 und PHAX, die sich beide in CBs befinden.[2] Das 5'-Ende der snRNA wird durch das CBC-Protein (Cap-Binding Complex) mit dem Komplex verbunden. (2) Nach Abschluss der Phase im Cytoplasma kehren die neu gebildeten snRNPs des Kerns in den Kern zurück und akkumulieren sich zunächst in CBs. Die genauen molekularen Signale, die die unfertigen snRNPs zu den CBs bringen, sind jedoch unbekannt. Coilin interagiert direkt mit snRNAs und den Sm-Proteinen und dient somit möglicherweise als CB-Zielsignal. Es wurde gezeigt, dass das Protein SART3 wichtig für die korrekte CB-Lokalisierung von U4- und U5-snRNAs ist. Auch der SMN-Komplex, der mit dem Sm-Ring im Cytoplasma interagiert, wurde vorgeschlagen, neue snRNPs zu den CBs zu bringen, indem eine Domäne im SMN-Protein mit Coilin wechselwirkt. Nach dem Import in den Cajal-Körper wird die neue snRNA durch Methylierung und durch Isomerisierung von Uridinen zu Pseudouridinen modifiziert. Die snRNPs müssen weiterhin mit snRNP-spezifischen Proteinen verbunden werden. Der letzte Schritt in der snRNP-Reifung ist die Bildung der spleißfähigen Moleküle U2- und U4/U6/U5-snRNPs (tri-snRPs). (3) Während des Spleißens durchläuft das tri-snRNP eine Umlagerung, die zur Freisetzung einzelner snRNPs aus dem Post-Spleiß-Spleißsystem führt. Die genaue molekulare Zusammensetzung von snRNPs nach dem Spleißen ist jedoch nicht genau definiert. (4) Die Cajal-Körper scheinen auch an der Wiederzusammenstellung von snRNPs nach dem Spleiß-Vorgang beteiligt zu sein. Der SMN-Komplex wurde auch im Zellkern (Gems und CBs) gefunden und wurde als wichtig für das snRNP-Recycling angesehen. So ist es plausibel, dass der nukleäre SMN-Komplex an der Reparatur von beschädigten Sm-Ringen beteiligt ist. Dies könnte in den CBs stattfinden. Eine alternative Hypothese deutet darauf hin, dass der SMN-Komplex den Sm-Ring während des snRNP-Abbaus demontiert. Die Qualität der snRNP-Bildung wird offenbar an mehreren Punkten entlang des Herstellungsweges kontrolliert. Zuerst sind weitere Proteine an der Erkennung und dem Abbau von anormalen snRNAs im Kern beteiligt. Ein molekularer Mechanismus, der beschreibt, wie falsch gefaltete snRNAs erkannt werden, ist jedoch unbekannt. Es wurde gezeigt, dass ein zusätzlicher Kontrollpunkt existiert, der die letzten Schritte der snRNP-Reifung kontrolliert, unausgereifte snRNPs sequestriert und nur reife Partikel in die Spleißreaktion eindringen lässt.[2] TelomereEine weitere Beziehung besteht zwischen Cajal-Körpern und den Telomeren. Während des größten Teils des Zellzyklus ist die Telomerase-RNA nur in Cajal-Körpern nachweisbar. In der S-Phase, wenn die Telomere verlängert werden, kann die Telomerase-RNA jedoch auch in einer Teilmenge von Telomeren nachgewiesen werden. Diese Telomere enthalten andere Komponenten des Telomerase-Holoenzyms, die sich dort normalerweise nicht ansammeln. Darüber hinaus wurden Cajal-Körper beobachtet, die während der S-Phase kurzfristige Assoziationen mit Telomeren eingehen. Diese Ergebnisse deuten darauf hin, dass spezifische Wechselwirkungen zwischen Cajal-Körpern und Telomeren während der Telomerverlängerung auftreten.[5] GemsDie Gemini of Cajal bodies oder Gems werden in der Nähe von Cajal-Körpern gefunden. Ihr Name ist von ihrer Konstellation ihrer engen „Zwillings“-Beziehung zu Cajal-Körpern abgeleitet. Gems sind in Größe und Form ähnlich wie Cajal-Körper und sind unter dem Mikroskop praktisch nicht zu unterscheiden.[6] Im Gegensatz zu Cajal-Körpern enthalten Gems keine kleinen nuklearen Ribonukleoproteine (snRNPs), sondern das Protein SMN. Es wird angenommen, dass Gems die Cajal-Körper bei der snRNP-Biogenese unterstützen,[7] obwohl es auch aus mikroskopischen Untersuchungen hervorgeht, dass Cajal-Körpern und Gems unterschiedliche Erscheinungsformen derselben Struktur sind.[6] Spätere Studien der Ultrastruktur haben gezeigt, dass Gems Zwillinge von Cajal-Körpern sind. Hierbei liegt der Unterschied in der Coilinkomponente: Cajal-Körper enthalten SMN- und Coilin-Proteine, und Gems enthalten SMN, jedoch kein Coilin.[8] Einzelnachweise
|