|
Bisoprolol
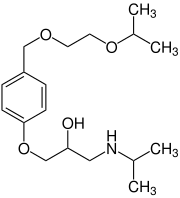
Bisoprolol ist ein Arzneistoff aus der Gruppe der selektiven β1-Adrenorezeptorenblocker (kurz Betablocker). Es wird zur Behandlung des Bluthochdrucks, der Angina Pectoris, der chronischen Herzinsuffizienz und bei Tachykardien eingesetzt. Chemisch gesehen handelt es sich um einen Phenolether, siehe Formel. Klinische AngabenAnwendungsgebiete (Indikationen)Bisoprolol wird zur Behandlung der arteriellen Hypertonie, der Angina Pectoris und der chronischen Herzinsuffizienz eingesetzt. Zur Verbesserung der Compliance und zur Vereinfachung der Therapie steht Bisoprolol in einer fixen Kombination mit dem Diuretikum Hydrochlorothiazid sowie dem Calciumantagonisten Amlodipin in ebenfalls abgestuften Wirkstärken zur Verfügung. GegenanzeigenDas Medikament sollte nicht bei langsamen Herzrhythmusstörungen (Bradykardie), bei Benutzung von MAO-Hemmern, bei Hypotonie, bei schwerer Herzinsuffizienz mit beginnendem kardiogenem Schock und bei Diabetes mellitus eingenommen werden. Bei Asthma bronchiale oder anderen chronisch obstruktiven Lungenfunktionsstörungen sollte das Medikament nur mit Vorsicht angewendet werden. Unerwünschte Wirkungen (Nebenwirkungen)Bisoprolol kann zahlreiche Nebenwirkungen hervorrufen.[4] Mögliche Nebenwirkungen werden anhand ihrer Häufigkeit unterteilt.
Pharmakologische EigenschaftenBisoprolol ist ein lang wirksamer β-Blocker, der bevorzugt an β1-Adrenorezeptoren bindet. Es wirkt am Herzen frequenzsenkend und negativ inotrop. Wegen seiner Lipophilie besitzt Bisoprolol auch zentralnervöse Wirkung. Wie Carvedilol zeigt es keine intrinsische sympathomimetische Aktivität (ISA). Nach oraler Gabe wird der β-Blocker rasch bei einer Bioverfügbarkeit von etwa 90 % resorbiert. Die Aufnahme von Dosen im Bereich von 1 bis 10 mg führen nach rund 3 h zur maximalen Plasmakonzentration. Die Halbwertszeit beträgt 10 bis 11 h, wobei die Hälfte der Substanz unverändert renal, der Rest über Abbau in der Leber eliminiert wird.[5] Der Wirkstoff wird als Racemat eingesetzt, wobei die Enantiomeren von Wirkstoffen in der Regel unterschiedliche pharmakologische Eigenschaften und Wirkungen haben.[6] MarktbedeutungMit rund 515 Mio. DDD war Bisoprolol nach Metoprolol im Jahr 2007 der am zweithäufigsten eingesetzte β-Blocker in Deutschland. Insgesamt hat sich die Anzahl der verordneten Dosen (nach DDD) von Betablockern von 1998 bis 2007 fast verdreifacht.[7] SyntheseDie Synthese von Bisoprolol kann in einer dreistufigen Reaktion erfolgen. 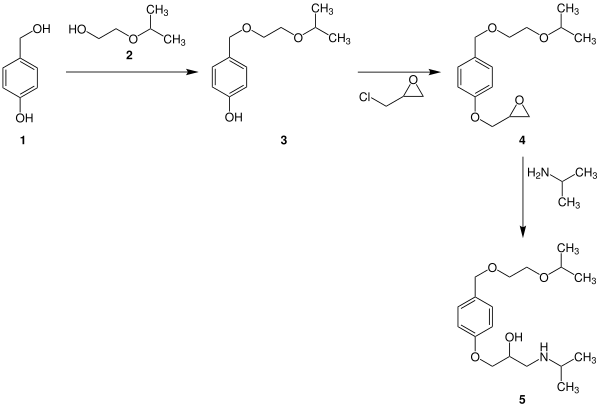 StereoisomerieDie Verbindung ist chiral und wird als Racemat, d. h. als 1:1-Mischung der beiden Enantiomere verwendet. Das aktive Stereoisomer (Eutomer) ist die (S)-Form.[9] Die Tabelle zeigt beide Stereoisomere. Hierbei unterscheiden sie sich in der Position des Wasserstoffatoms, welches in dieser Darstellung entweder in die Zeichenebene hineingeht oder aus der Zeichenebene herausragt:
HandelsnamenBilol (CH), Bisacardiol (A), Bisocor (A), Bisoprolol (B, D), Concor (D, A, CH), Concor COR (D, A), Rivacor (A), zahlreiche Generika (D, A, CH) In Kombination mit Hydrochlorothiazid: Concor plus (D, CH), Bilol comp (CH), Lodoz (CH), Rivacor plus (A), Generika (D, A, CH); In Kombination mit Amlodipin: Bisodipin (D) Einzelnachweise
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||