|
Asinger-Reaktion Die Asinger-Reaktion oder auch Asinger-Thiazolin-Synthese ist eine Reaktion aus dem Bereich der Organischen Chemie. Sie wurde durch Friedrich Asinger während seines Zwangsaufenthaltes in der Sowjetunion – im Rahmen der Deportation deutscher Wissenschaftler (Aktion Ossawakim) – entdeckt.[1] Die Asinger-Reaktion zählt zu den Mehrkomponentenreaktionen und wird auch als A-4CR (Abkürzung für Asinger-Vierkomponentenreaktion) klassifiziert: Aus elementarem Schwefel, einem α-substituierbaren Keton oder Aldehyd, einer weiteren Carbonylkomponente und Ammoniak entstehen in guter Ausbeute 3-Thiazoline[2] oder Gemische mehrerer 3-Thiazoline.   AlternativenAlternativ können 3-Thiazoline auch aus α-Mercaptoaldehyden oder α-Mercaptoketonen, einer Oxokomponente (Aldehyd oder Keton) und Ammoniak entstehen.[3] Damit die Reaktion ablaufen kann, muss an das α-Kohlenstoffatom (Kohlenstoffatom neben dem Carbonyl-Kohlenstoffatom) mindestens ein Wasserstoffatom gebunden sein (sowohl bei der Reaktion mit einem Aldehyd als auch bei der mit einem Keton). MechanismusBeispielhaft wird der Mechanismus mit einem Aldehyd (R3 = H) dargestellt, alternativ kann die Reaktion auch mit einem Keton (R3 = Organylgruppe, z. B. Alkylgruppe) stattfinden. Diese verläuft analog. Erster Schritt: Durch eine Thiolierungsreaktion bildet sich intermediär ein α-Mercaptoaldehyd (R3 = H) oder ein α-Mercaptoketon (R3 = Organylgruppe). Bei der α-Thiolierung wird basenkatalysiert – hier im Speziellen aminkatalysiert (durch den Einsatz von Ammoniak) – das H-Atom in α-Stellung ersetzt. Die Reaktion wird durch ein Aldehyd eingeleitet. 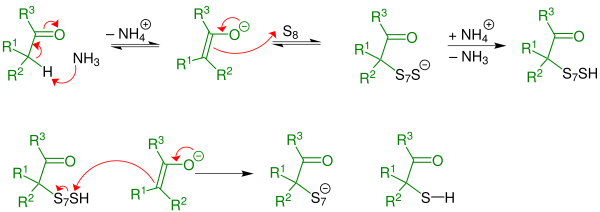 Zweiter Schritt: Der α-Mercaptoaldehyd reagiert irreversibel mit einem zweiten Aldehyd-Molekül und Ammoniak zum 3-Thiazolin. Das zweite Aldehyd-Molekül tritt hier als „Oxokomponente“ in die Ringschlussreaktion ein. Es handelt sich um eine α-Amino-alkylierung einer SH-aciden Verbindung mit folgender cyclischer Stabilisierung durch Wasserabspaltung.  VariantenEine universellere Variante der Asinger-Reaktion wurde bei der Degussa AG entwickelt. Dabei reagiert eine α-halogenierte Carbonyl-Komponente mit Natriumhydrogensulfid und generiert in situ eine α-Mercapto-Carbonyl-Komponente (Thiol), welche direkt mit Aldehyden oder Ketonen und Ammoniak zu 3-Thiazolinen weiterreagieren:[4]  In der chemischen Industrie wurden, basierend auf der Asinger-Reaktion, mehrstufige Verfahren zur Herstellung des Arzneistoffes D-Penicillamin[5] (Penicillamin: R = Methylgruppe) und von DL-Cystein (R = H)[6] entwickelt und im technischen Maßstab betrieben.  Die Synthese von 3-Oxazolinen (Sauerstoff-Analoga der 3-Thiazoline) erfolgt nach einer Variante der Asinger-Reaktion aus 2-Halogenaldehyden, Ammoniak, Natronlauge und einer Oxokomponente (meist ein Keton).[7] Einzelnachweise
Literatur
WeblinksCommons: Asinger reaction – Sammlung von Bildern, Videos und Audiodateien
|