| Strukturformel
|
|
| Allgemeines
|
| Name
|
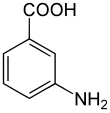
3-Aminobenzoesäure
|
| Andere Namen
|
- m-Aminobenzoesäure
- meta-Aminobenzoesäure
- 3-Carboxyanilin
|
| Summenformel
|
C7H7NO2
|
| Kurzbeschreibung
|
beiger Feststoff[1]
|
| Externe Identifikatoren/Datenbanken
|
|
|
| Eigenschaften
|
| Molare Masse
|
137,14 g·mol−1
|
| Aggregatzustand
|
fest
|
| Dichte
|
1,51 g·cm−3[1]
|
| Schmelzpunkt
|
174 °C[1]
|
| pKS-Wert
|
3,07; 4,79[2]
|
| Löslichkeit
|
schlecht in Wasser (5,9 g·l−1 bei 20 °C)[1]
|
| Sicherheitshinweise
|
|
|
| Toxikologische Daten
|
6300 mg·kg−1 (LD50, Maus, oral)[3]
|
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa).
|
3-Aminobenzoesäure ist eine organische Carbonsäure, die zur Herstellung von Azofarbstoffen verwendet wird. Neben der 3-Aminobenzoesäure existieren zwei weitere stellungsisomere Formen: die Anthranilsäure (o-Aminobenzoesäure) und die 4-Aminobenzoesäure (p-Aminobenzoesäure).
Gewinnung und Darstellung
3-Aminobenzoesäure kann durch die Reduktion von 3-Nitrobenzoesäure erhalten werden. Als Reduktionsmittel eignen sich beispielsweise elementares Zink in Salzsäure[4] oder Hydrazin[5].
Toxikologie
3-Aminobenzoesäure zeigt geringe Toxizität. Außerdem wurden keine Hinweise auf Reproduktionstoxizität, Mutagenität und Kanzerogenität gefunden.[1]
Weblinks
Einzelnachweise
- ↑ a b c d e f g Eintrag zu 3-Aminobenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ CRC Handbook of Chemistry and Physics, 85th Edition, CRC Press, Boca Raton, 2004.
- ↑ Datenblatt 3-Aminobenzoesäure bei Sigma-Aldrich, abgerufen am 8. November 2008 (PDF).Vorlage:Sigma-Aldrich/Name nicht angegeben
- ↑ J. Wilbrand, F. K. Beilstein: Ueber eine neue Reihe isomerer Verbindungen der Benzoëgruppe. – Nitrodracylsäure und deren Derivate, in: J. Liebigs Ann. Chem., 1863, 128, S. 257–273; doi:10.1002/jlac.18631280302, (PDF).
- ↑ T. Curtius: Die Einwirkung von Hydrazinhydrat auf Nitroverbindungen. In: J. für prakt. Chemie 184, 233–237 (1907), Digitalisat auf Gallica.

