|
| Strukturformel
|
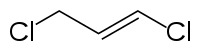

|
| unten: cis-Isomer, oben: trans-Isomer
|
| Allgemeines
|
| Name
|
1,3-Dichlorpropen
|
| Andere Namen
|
- Chlorallylchlorid
- 1,3-Dichlor-1-propen
- 1,3-DCP
|
| Summenformel
|
C3H4Cl2
|
| Kurzbeschreibung
|
flüchtige, entzündliche, farblose bis gelbliche Flüssigkeit mit süßlich stechendem, chloroformartigem Geruch[1][2]
|
| Externe Identifikatoren/Datenbanken
|
|
|
| Eigenschaften
|
| Molare Masse
|
110,97 g·mol−1
|
| Aggregatzustand
|
flüssig[2]
|
| Dichte
|
- 1,23 g·cm−3 [2]
- 1,22 g·cm−3 (cis)[1]
|
| Schmelzpunkt
|
−84 °C[2]
|
| Siedepunkt
|
|
| Dampfdruck
|
- 37 hPa (20 °C)[2]
- 53–69 hPa (20 °C) (cis)[1]
|
| Löslichkeit
|
schlecht in Wasser (1 g·l−1 bei 20 °C)[2]
|
| Brechungsindex
|
- 1,4682 (cis, 20 °C)[3]
- 1,4730 (trans, 20 °C)[3]
|
| Sicherheitshinweise
|
|
|
| MAK
|
Schweiz: 0,11 ml·m−3 bzw. 0,5 mg·m−3[5]
|
| Toxikologische Daten
|
|
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C
|
1,3-Dichlorpropen ist eine chemische Verbindung aus der Gruppe der ungesättigten Chlorkohlenwasserstoffe und Alkene.
Isomerie
Die Doppelbindung von 1,3-Dichlorpropen kann (E)- oder (Z)-konfiguriert vorliegen. Ohne besondere Herstellungsmethoden oder Aufreinigungstechnikern liegt 1,3-Dichlorpropen meist in Form einer Gleichgewichtsmischung der isomeren cis- und trans-1,3-Dichlorpropen vor.
Geschichte
1,3-Dichlorpropen wurde 1945 als künstliches Bodenbegasungsmittel eingeführt. Ab 1956 wurde es durch Restriktionen bei der Verwendung von Ethylendibromid, Dibromchlorpropen[S 1] und Methylbromid extensiv eingesetzt.[6]
Gewinnung und Darstellung
1,3-Dichlorpropen entsteht als Nebenprodukt bei der Herstellung von Allylchlorid durch Chlorierung von Propen bei hohen Temperaturen. Alternativ kann es aus 1,3-Dichlorpropanol durch Dehydratisierung mit POCl3 oder mit P4O10 in Benzol gewonnen werden. Das technische Produkt enthält häufig 1,2-Dichlorpropan und 2,3-Dichlorpropen[S 2] als Verunreinigungen.[6]
Verwendung
1,3-Dichlorpropen wurde hauptsächlich als Pestizid und Nematizid in der Landwirtschaft als Bodenbegasungsmittel und als Desinfektionsmittel (z. B. bei der Containerbegasung) eingesetzt, wobei cis-1,3-Dichlorpropen wirksamer ist. In Deutschland wurde Dichlorpropen häufig im Grundwasser nachgewiesen,[7] wobei der Einsatz in Deutschland seit 2003 vollständig verboten (BGBl. I S. 1533), in Afrika und den USA aber noch üblich (z. B. für Tabak, Mohrrüben, Kartoffeln und Erdbeeren) ist.[8]
Sicherheitshinweise
Die Dämpfe von 1,3-Dichlorpropen können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 27 °C, untere/obere Explosionsgrenze 5,7/14,5 Volumenprozent) bilden. Die Verbindung zersetzt sich bei hohen Temperaturen, wobei Chlorwasserstoff entsteht. 1,3-Dichlorpropen ist mit Spezifischer Zielorgan-Toxizität Kategorie 3 (einmalige Exposition) und als giftig beim Verschlucken und bei Hautkontakt eingestuft.[2]
Nachweis
1,3-Dichlorpropen kann nach Adsorption an Aktivkohle mit nachfolgender Desorption durch Headspace-Gaschromatographie nachgewiesen werden.[9]
Weblinks
- Patent DE69502284T2: Drehströmungsreaktor. Angemeldet am 20. Juni 1995, veröffentlicht am 20. August 1998, Anmelder: Shell Internationale Research Maatschappij B.V., Erfinder: Paul Marie Ayoub, Jean Charles Ginestra (Zur Herstellung von Allylchlorid und Dichlorpropen).
- Patent DE2540336: Verfahren zur Abtrennung von 1,3-Dichlorpropen aus Allylchlorid-Destillationssumpfprodukten. Veröffentlicht am 10. September 1975, Anmelder: Dow Chemical Co, Erfinder: John Bruce Ivy, Gordon Grady Willis, Jackson Lake, David Charles Kelsoe.
Einzelnachweise
- ↑ a b c d Eintrag zu cis-1,3-Dichlorpropen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ a b c d e f g h i j k l Eintrag zu 1,3-Dichlorpropen, Isomerengemisch in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-160.
- ↑ Eintrag zu 1,3-dichloropropene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 542-75-6 bzw. 1,3-Dichlorpropen (cis und trans)), abgerufen am 5. Oktober 2019.
- ↑ a b c Poisons Information Monograph (PIM) für Dichloropropene, 1,3-, abgerufen am 9. Dezember 2014.
- ↑ Häufig nachgewiesene Pestizid-Wirkstoffe und Metabolite (1996–2000) (Memento vom 18. April 2007 im Internet Archive)
- ↑ pan-germany.org: Gläserner Pflanzenschutz (PDF; 305 kB)
- ↑ BG RCI: Verfahren zur Bestimmung von cis- und trans-1,3-Dichlorpropen, abgerufen am 21. Januar 2023.
Anmerkungen
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 1,2-Dibrom-1-chlorprop-1-en: CAS-Nr.: 143089-09-2, PubChem: 71344625, ChemSpider: 28686713, Wikidata: Q82730788.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2,3-Dichlorpropen: CAS-Nr.: 78-88-6, EG-Nr.: 201-153-8, ECHA-InfoCard: 100.001.049, GESTIS: 510163, PubChem: 6565, ChemSpider: 6317, Wikidata: Q27256607.
|






