|
حمض النتروز
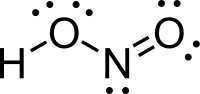
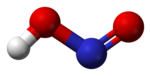
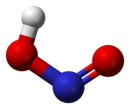
حمض النتروز هو حمض ضعيف أحادي البروتون يتكون من النتروجين والهيدروجين والأكسجين، وله الصيغة الكيميائية HNO2، ويوجد فقط على شكل محلول، ذي لون أزرق فاتح. يحصل من حمض النتروز على أملاح النتريت المختلفة. التحضيريحضر حمض النتروز من تفاعل ثنائي أكسيد النتروجين مع الماء في تفاعل عدم تناسب، مثلما يحدث في عملية أوستفالد على سبيل المثال، بحيث نحصل على حمض النتريك وحمض النتروز: يمكن التحضير مخبرياً من تفاعل حمض الكبريتيك الممدد مع أحد أملاح النتريت مثل نتريت الباريوم.[3] الخصائصيوجد حمض النتروز على شكل محلول فقط ولا يمكن عزله بشكل نقي. يؤدي التسخين إلى حدوث تفاعل عدم تناسب، حيث يتفكك وذلك إلى حمض النتريك وأحادي أكسيد النتروجين [3] يؤدي تفاعل حمض النتروز مع المحاليل القلوية إلى تشكيل أملاح النتريت الموافقة. فعند تفاعل حمض النتروز مع محلول هيدروكسيد الصوديوم الممدد ينتج نتريت الصوديوم: يمكن لجزيئات حمض النتروز أن تتبنى بنية جزيئية من النمط مقرون cis أو النمط مفروق trans، مع العلم أن النمط مفروق trans هو السائد في الشروط العادية، إذ تشير حسابات مطيافية الأشعة تحت الحمراء أن طاقة غيبس الحرة الدالة على الاستقرار هي حوالي 2.3 كيلوجول/مول.[4]
الاستخداماتيستخدم حمض النتروز من أجل تحضير أملاح الديازونيوم.[3] طالع أيضاًالمراجع
|
||||||||||||||||||||||||||||||||||||||||||||||