|
Teori medan liganTeori medan ligan (Bahasa Inggris: Ligand Field Theory), disingkat LFT, adalah sebuah teori yang menjelaskan ikatan pada senyawa kompleks koordinasi.[1] Ia merupakan aplikasi teori orbital molekul pada kompleks logam transisi. Ion logam transisi mempunyai enam orbital atom terhibridisasi dengan energi yang sama untuk berikatan dengan ligan-ligannya. Analisis LFT bergantung pada geometri kompleks. Walaupun begitu, untuk tujuan tertentu, kebanyakan analisis berfokus pada kompleks oktahedral dengan enam ligan berkoordinasi dengan logam.[2] Ikatan σOrbital-orbital molekul yang dibentuk oleh koordinasi dapat dilihat sebagai akibat dari donasi dua elektron oleh tiap-tiap donor σ ligan ke orbital-d logam. Pada kompleks oktahedral, ligan mendekat ke logam sepanjang sumbu x, y, dan z, sehingga orbital simetri σ nya membentuk kombinasi ikatan dan anti-ikatan pada orbital dz2 dan dx2−y2. Orbital dxy, dxz dan dyz yang tersisa menjadi orbital non-ikatan. Beberapa interaksi ikatan (dan anti-ikatan) yang lemah dengan orbital s dan p logam juga terjadi, menghasilkan total 6 orbital molekul ikatan (dan 6 orbital anti-ikatan).[butuh rujukan] 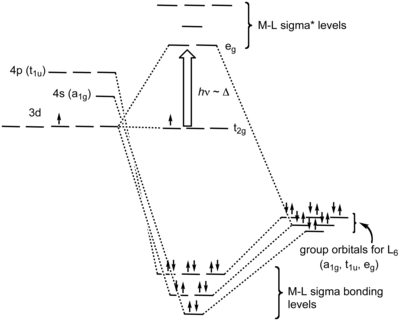 Dalam istilah simetri molekul, enam orbital pasangan menyendiri ligan-ligan membentuk enam kombinasi linear simetri tersuai (Bahasa Inggris: Symmetry adapated linear combination) orbital atau juga disebut sebagai orbital kelompok ligan (ligand group orbitals). Representasi taktereduksinya adalah a1g, t1u dan eg. Logam juga mempunyai enam orbital valensi yang memiliki representasi taktereduksi yang sama, yaitu orbital s berlabel a1g, orbital p berlabel t1u, dan orbital dz2 beserta dx2−y2 berlabel eg. Enam orbital molekul ikatan σ dihasilkan oleh kombinasi orbital SALC ligan dengan orbital logam yang bersimetri sama.[butuh rujukan] Ikatan πIkatan π pada kompleks oktahedral terbentuk dengan dua cara: via orbital p ligan yang tidak digunakan pada ikatan σ, ataupun via orbital molekul π atau π* yang terdapat pada ligan. Orbital-orbital p logam digunakan untuk ikatan σ, sehingga interaksi π terjadi via orbital d, yakni dxy, dxz dan dyz. Orbital-orbital ini adalah orbital yang tidak berikatan apabila hanya terjadi ikatan σ.[butuh rujukan] Satu ikatan π pada kompleks koordinasi yang penting adalah ikatan π logam ke ligan, juga dikenal sebagai ikatan balik π. Ia terjadi ketika LUMO ligannya adalah orbital π* anti-ikatan. Orbital-orbital ini berenergi sangat dekat dengan orbital-orbital dxy, dxz dan dyz orbitals, sehingga mereka dapat membentuk orbital ikatan. Orbital anti-ikatan ini berenergi lebih tinggi daripada orbital anti-ikatan dari ikatan σ bonding, sehingga setelah orbital ikatan π yang baru terisi dengan elektron dari orbital-orbital d logam, ΔO meningkat dan ikatan antara ligan dengan logam menguat. Ligan-ligan pada akhirnya memiliki elektron pada orbital molekul π*-nya, sehingga ikatan π pada ligan melemah.[butuh rujukan] Bentuk koordinasi ikatan π yang lain adalah ikatan ligan ke logam. Hal ini terjadi apabila orbital simetri- π p atau orbital π pada ligan terisi. Ia bergabung dengan orbital dxy, dxz dan dyz logam, dan mendonasikan elektron-elektronnya, sehingga menghasilkan ikatan simetri-π antara ligan dengan logam. Ikatan logam-ligan menguat oleh interaksi ini, namun orbital molekul anti-ikatan dari ikatan ligan ke logam tidak setinggi orbital molekul anti-ikatan dari ikatan σ. Ia terisi dengan elektron yang berasal dari orbital d logam dan menjadi HOMO kompleks tersebut. Oleh karena itu, ΔO menurun ketika ikatan ligan ke logam terjadi.[butuh rujukan] Stabilisasi yang dihasilkan oleh ikatan logam ke ligan diakibatkan oleh donasi muatan negatif dari ion logam ke ligan. Hal ini mengizinkan logam menerima ikatan σ lebih mudah. Kombinasi ikatan σ ligan ke logam dan ikatan π logam ke ligan merupakan efek sinergi dan memperkuat satu sama lainnya.[butuh rujukan] Karena enam ligan mempunyai dua orbital simetri π, terdapat total keseluruhan dua belas orbital tersebut. Kombinasi linear simetri tersuainya mempunyai empat degenerat triplet representasi taktereduksi, salah satunya bersimetri t2g. Orbital dxy, dxz dan dyz pada logam juga mempunyai simetri ini, sehingga ikatan π yang terbentuk antara logam pusat dengan enam ligan juga mempunyai simetri tersebut.[butuh rujukan] Referensi
Lihat pula |